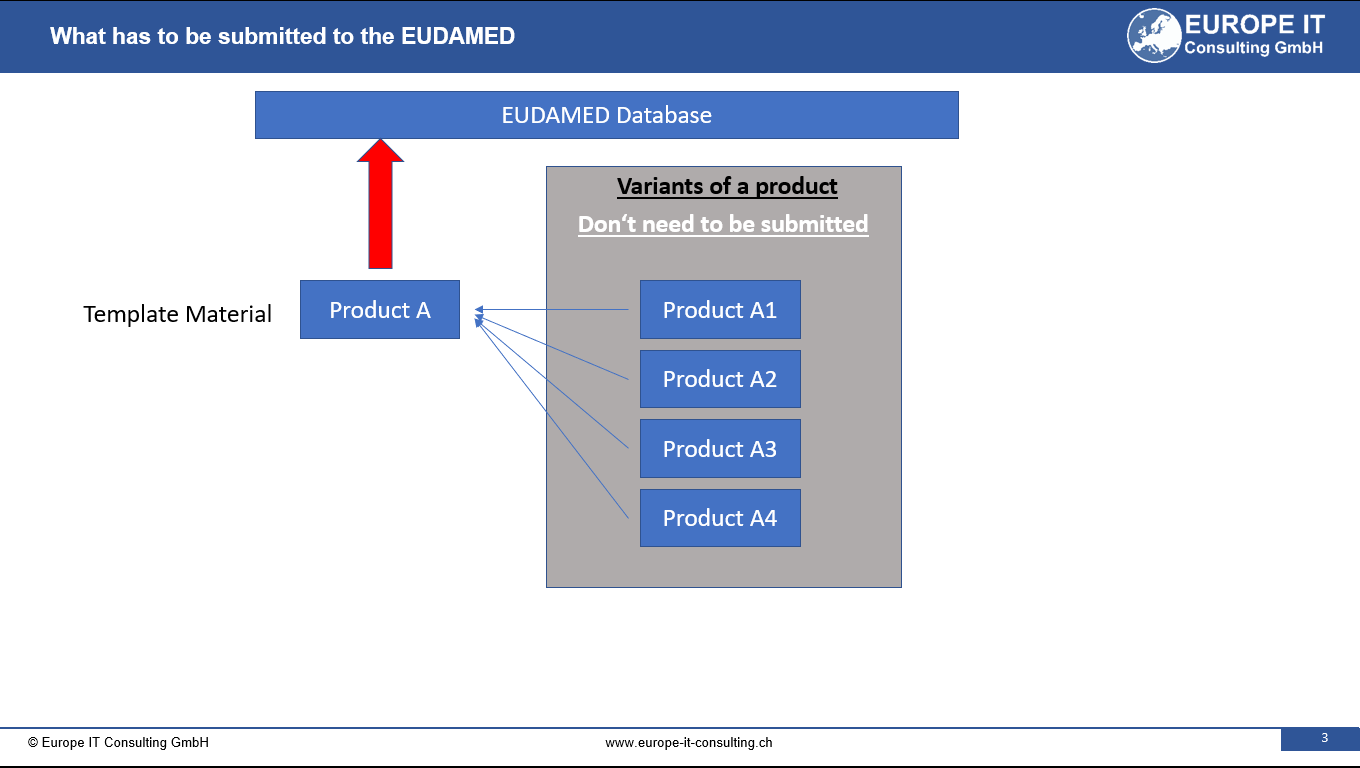
Fechas clave: Requisitos UDI en Australia

Nuevos horarios para la identificación única de dispositivos (UDI) en Australia La Administración Australiana de Bienes Terapéuticos (TGA) ha anunciado los calendarios obligatorios para la introducción de los requisitos de…