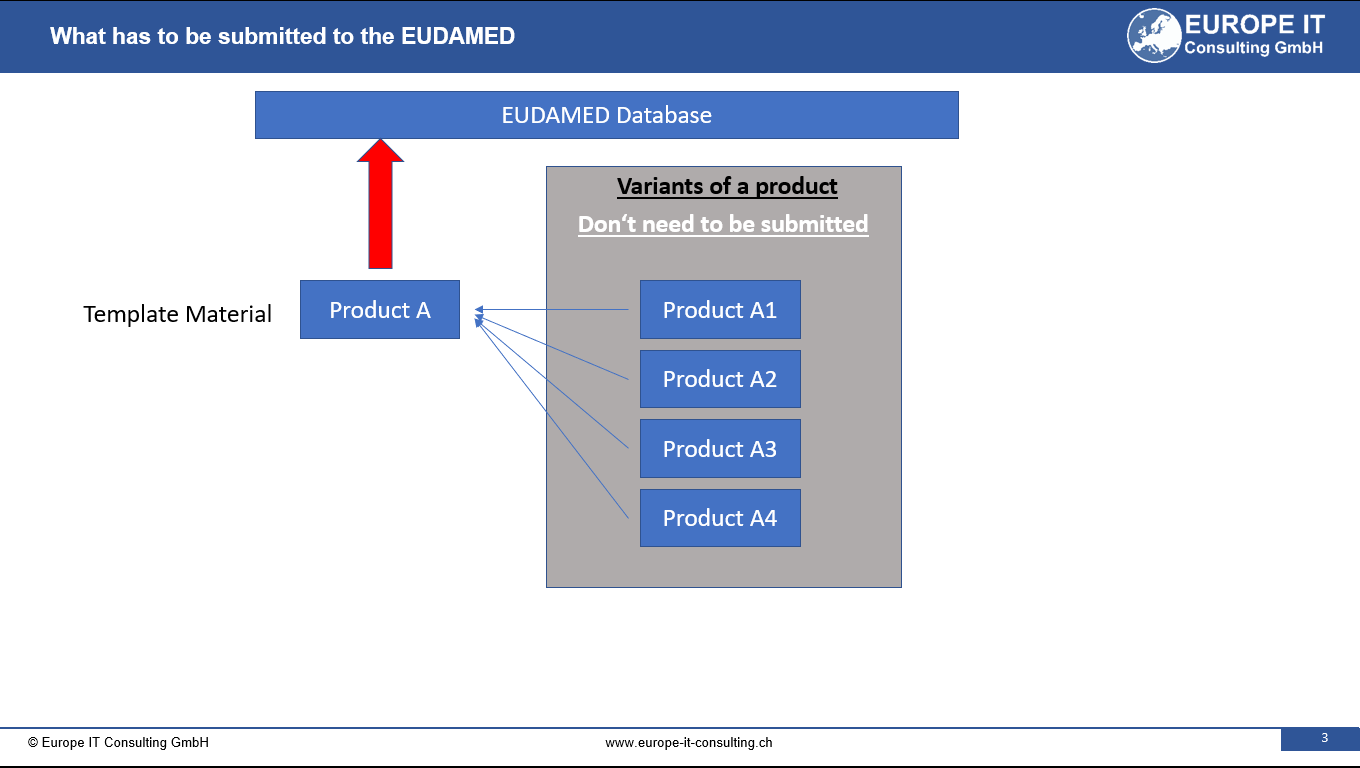
La introducción de la regulación de dispositivos médicos trajo consigo un cambio significativo: la asignación de identificadores únicos de dispositivos (UDI) para dispositivos médicos.
Este paso se ha dado para mejorar la identificación, trazabilidad y seguimiento de los dispositivos médicos, a la vez que se combate la falsificación. Un hito importante en este camino es la implementación del llamado Master UDI-DI.
¿Qué es el maestro UDI-DI ?
Su objetivo principal es crear una capa adicional de identificación para productos y dispositivos médicos específicos. Este enfoque innovador permite una agrupación más eficiente de dispositivos altamente individualizados y, por lo tanto, reduce la cantidad de entradas de datos en la base de datos EUDAMED (módulo UDI).
El principal desafío comercial del Master UDI-DI radica en la categorización efectiva de dispositivos altamente individualizados. Este enfoque no solo da como resultado una menor cantidad de entrada de datos en la base de datos EUDAMED, sino que también ayuda a proporcionar información más detallada del producto mediante el uso de identificadores de aplicación adicionales para las especificaciones clínicas.
Implementación y beneficios
El maestro UDI-DI se coloca como identificador de producto (PI) en el código de barras UDI en el embalaje o la etiqueta del producto. Es posible que las especificaciones y requisitos precisos para el Master UDI-DI no hayan sido definidos definitivamente por EUDAMED (BASE de datos europea de productos sanitarios) en este momento.
Las primeras categorías de productos que requieren el Master UDI-DI incluyen lentes de contacto, lentes graduadas y lectores listos para usar. Sin embargo, es importante destacar que la lista de productos con un alto grado de personalización podría ampliarse en el futuro.

La implementación del Master UDI-DI puede parecer un obstáculo adicional, pero desempeña un papel esencial en el proceso de identificación y trazabilidad de los dispositivos médicos.
Esta medida subraya la búsqueda continua de una mayor seguridad, calidad y eficiencia en el campo de los productos médicos.
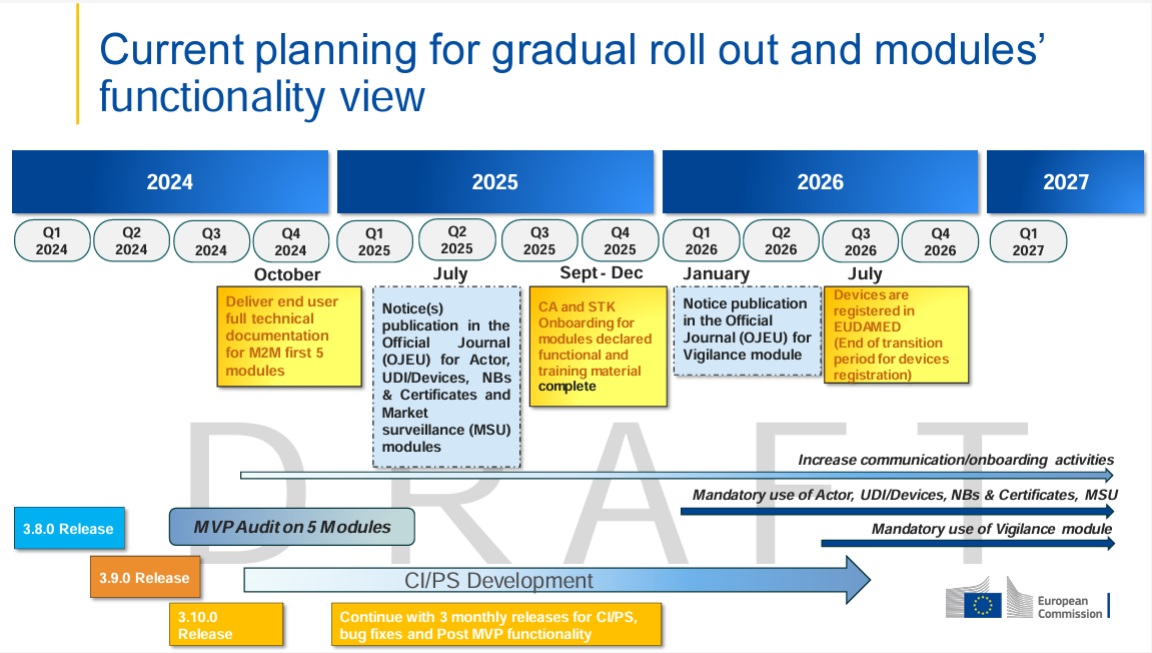
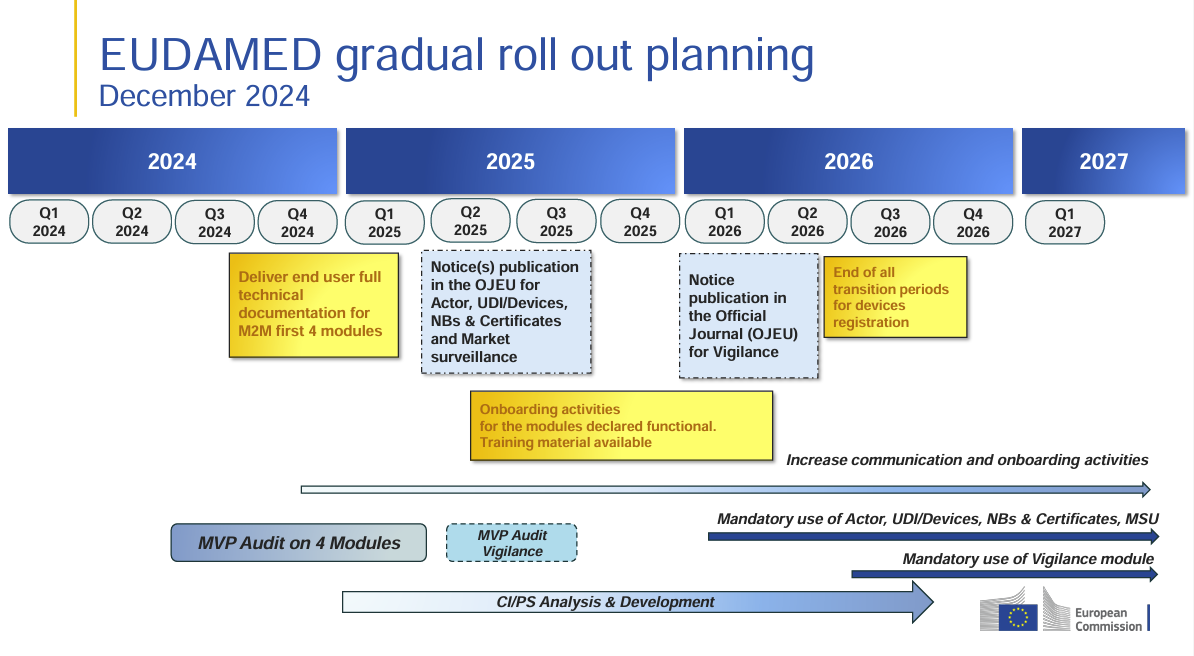
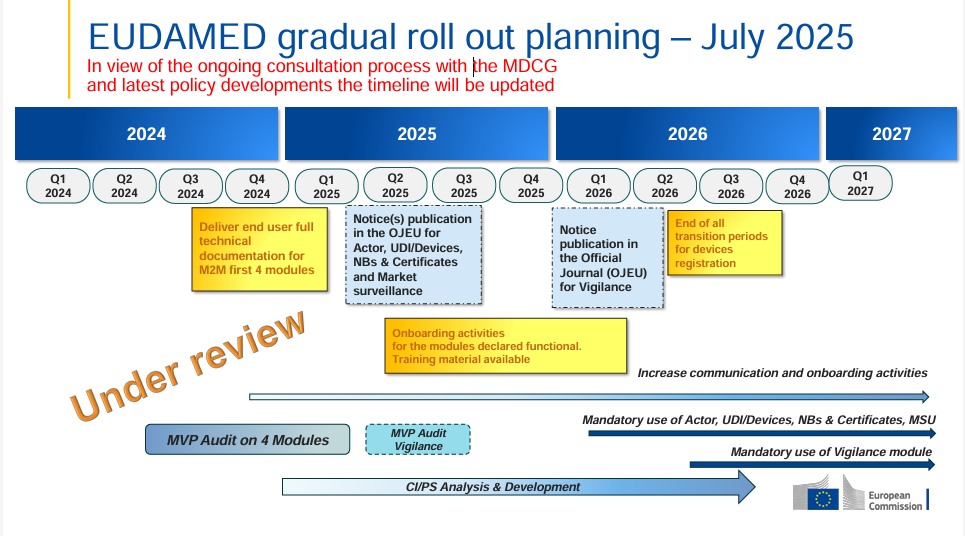
Evolución actual del Master UDI-DI en EUDAMED
Con la última actualización del entorno de pruebas EUDAMED (Playground), se ha dado un paso importante hacia la implementación concreta de la funcionalidad Master UDI-DI. Los fabricantes ahora pueden registrar ciertos productos altamente individualizados, como lentes de contacto estándar, lentes RGP dimensionalmente estables o lentes de gafas hechas a medida, bajo un Master UDI-DI .
Esta expansión permite a las empresas que distribuyen grandes cantidades de estos tipos de productos utilizar solo un maestro UDI-DI para toda una familia de productos, en lugar de registrar cada variante por separado.

Nuevo elemento de menú para Master UDI-DI en el entorno de prueba EUDAMED.
¿Cuándo se requiere un maestro UDI-DI?
La obligación de crear un maestro UDI-DI se desencadena por ciertos criterios:
-
Los productos pertenecen al mismo grupo de productos genéricos.
-
Tienen especificaciones individuales (por ejemplo, visión, curvatura, cilindro).
-
Se clasifican de acuerdo con el mismo conjunto de reglas de MDR.
-
Están sujetos a los mismos riesgos y evaluaciones clínicas.
Ejemplo: un fabricante de lentes de contacto puede registrar todas las variantes de un tipo determinado (por ejemplo, lentes mensuales de diferentes potencias) bajo un UDI-DI maestro.

Selección de tipos de productos, por ejemplo, «Standard soft contact lenses»

Selección total con nota: «Registration is not possible currently …»

Enfoque en los tipos de lentes, incluido «Standard soft contact lenses»
💡 Nota: Esta opción solo está disponible actualmente en el entorno de prueba. Se espera que la función se ejecute en vivo después de que se completen las pruebas adicionales.
Máscara de entrada EUDAMED: igual pero ampliada
Aunque el elemento de menú cambia al seleccionar un maestro UDI-DI, los campos y requisitos subyacentes coinciden con los de otros productos MDR. Por lo tanto, la máscara de entrada sigue siendo familiar, lo que facilita la familiarización.

Entrada del maestro UDI-DI y del organismo emisor correspondiente.

Características como uso único, reutilización y esterilización antes de su uso.
Nuestro apoyo a los fabricantes
Europe IT Consulting apoya activamente a los fabricantes en la correcta implementación de las obligaciones de Master UDI-DI:
-
Comprobación de la idoneidad de los productos para un Master UDI-DI
-
Proporcionar plantillas de Excel compatibles para la captura de UDI
-
Generación automatizada de XML para EUDAMED
-
Transferencias de prueba en el entorno de EUDAMED Playground
-
Formación y asesoramiento individual







Related Posts