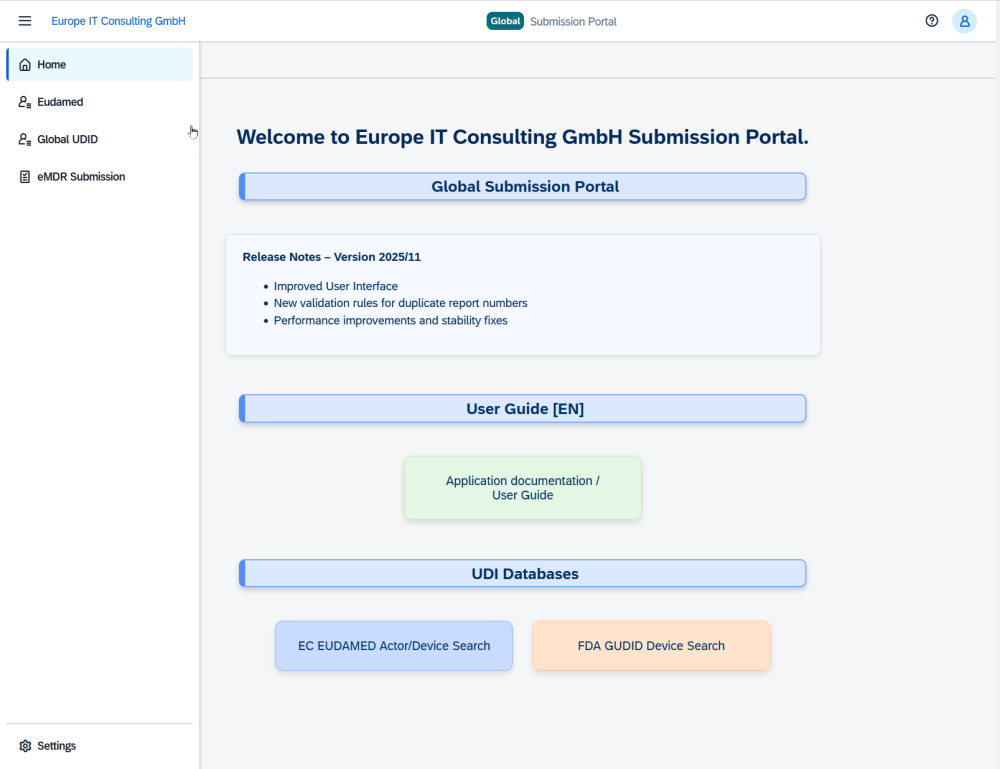
Europe IT Consulting presenta el Global Submission Portal con un enfoque en FDA eMDR
Nueva plataforma en la nube que combina eMDR, GUDID y EUDAMED en un único sistema
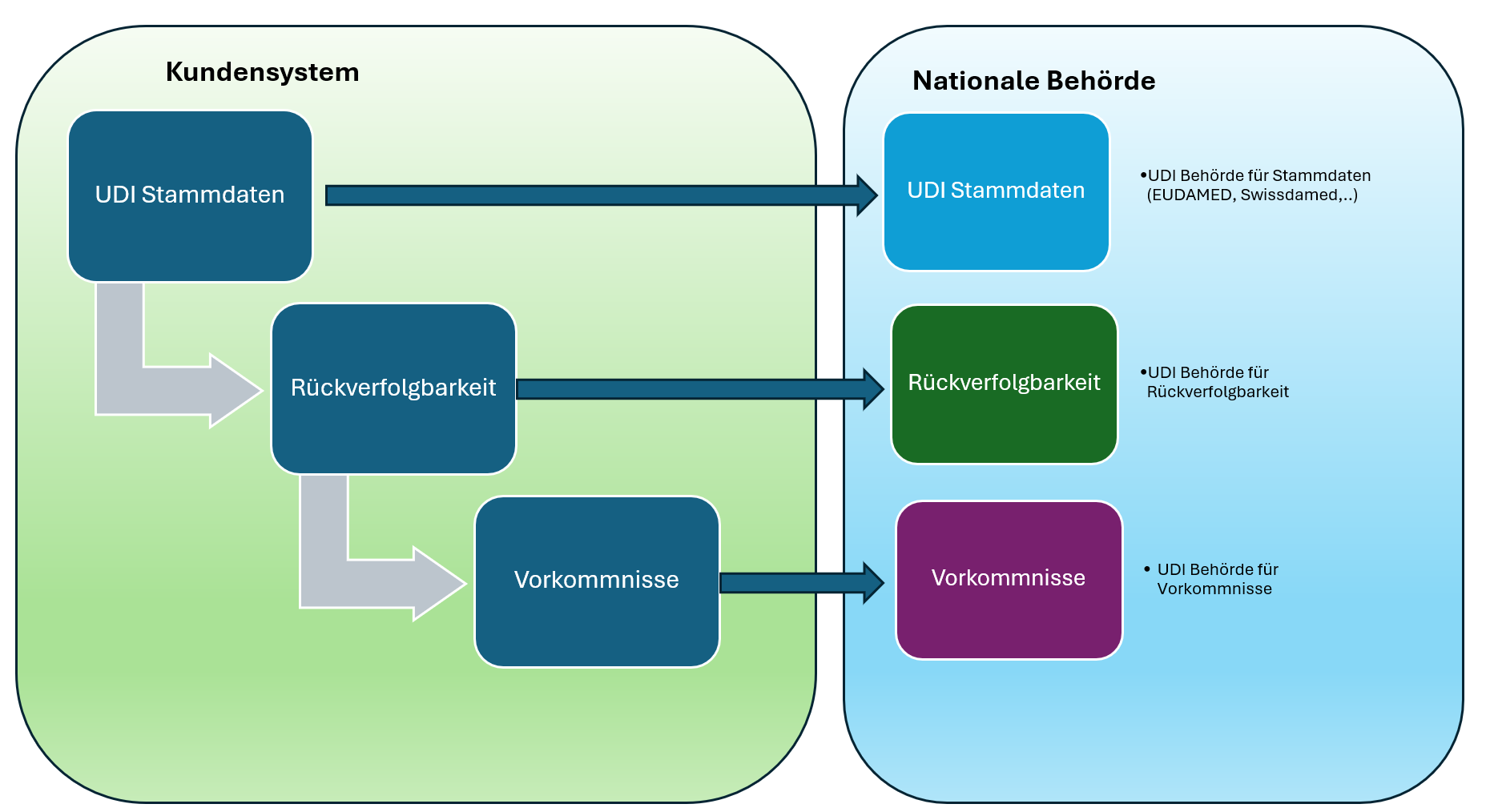
Con el Global Submission Portal, Europe IT Consulting lanza una plataforma en la nube que simplifica de forma significativa el complejo proceso de los envíos FDA eMDR. Además, la solución soporta UDI para FDA GUDID y EUDAMED, convirtiéndose así en una plataforma central para las presentaciones globales ante autoridades seleccionadas.
Los fabricantes de dispositivos médicos se enfrentan al reto de gestionar informes y datos UDI en distintos formatos y portales. Especialmente en el área de vigilancia, la presión de tiempo es alta, y los errores pueden tener un impacto directo en plazos y cumplimiento normativo.
Por qué FDA eMDR está en el centro de atención
La notificación electrónica de incidentes a la FDA (Electronic Medical Device Reporting, eMDR) es técnicamente exigente: estructura HL7 ICSR, ESG Submission Gateway, múltiples mensajes ACK y validaciones estrictas. Muchas empresas siguen trabajando aquí con cargas manuales y herramientas separadas.
Europe IT Consulting aborda precisamente este punto de dolor: el Global Submission Portal está diseñado para que los casos eMDR puedan procesarse de forma estructurada, automatizada y totalmente trazable, sin que los departamentos especializados necesiten conocimientos de HL7 o XML.
FDA eMDR como módulo central en el Global Submission Portal
El módulo FDA eMDR es uno de los tres pilares centrales del Global Submission Portal:
Captura de casos basada en Excel
Los departamentos especializados registran toda la información relevante (p. ej., Adverse Event, Product Problem) en una plantilla Excel estructurada y alineada con los requisitos de la FDA.
Conversión y envío automáticos
A partir de los datos en Excel, se genera en segundo plano un archivo XML HL7 ICSR válido, que se transmite a la FDA a través de una conexión M2M mediante el ESG Submission Gateway, sin manejo manual en la herramienta eSubmitter.
Gestión de ACK y vista de estado en el portal
Las confirmaciones (mensajes ACK) devueltas por la FDA se procesan automáticamente y se muestran en el portal con estados claramente comprensibles, desde “Uploaded” y “Processing” hasta “Success” o “Failed”.
Errores de validación y centro de descargas
Si se producen errores de validación, estos se muestran con detalles (por ejemplo, sección, XPath, mensaje de la autoridad). Los archivos de resultados y las respuestas de la autoridad –como los ACK de la FDA– pueden descargarse de forma conjunta como archivo ZIP o individualmente.
De este modo, el Global Submission Portal se convierte en la interfaz central a través de la cual los equipos de vigilancia y asuntos regulatorios pueden gestionar sus envíos eMDR desde la captura inicial hasta la confirmación final.
Módulos adicionales: envío UDI a FDA GUDID y EUDAMED
Además de eMDR, el Global Submission Portal cubre otras dos áreas clave de compliance:
-
FDA GUDID – Soporte para el envío de datos UDI a la Global UDI Database para el mercado estadounidense
-
EUDAMED – Presentaciones UDI conformes con el EU MDR a la base de datos europea de productos sanitarios
También aquí se aplican los mismos principios: carga basada en Excel, validación automática y seguimiento transparente del estado de todas las presentaciones.
Más información y solicitud de demo
El Global Submission Portal está disponible de inmediato.
Para más información, visita:
Página del producto: https://www.europe-it-consulting.ch/global-submission-portal/?lang=es






Related Posts