
¿Qué es un «dispositivo activo» según el MDR y el IVDR?
🩺 Introducción
El Reglamento de Productos Sanitarios (MDR, UE 2017/745) y el Reglamento de Diagnósticos In Vitro (IVDR, UE 2017/746) han endurecido significativamente los requisitos para los productos sanitarios y los diagnósticos in vitro (DIV) en Europa.
Una de las clasificaciones clave se refiere a los «dispositivos activos».
Pero, ¿qué son exactamente los dispositivos activos y qué requisitos normativos les aplican?
🧾 Definición de «dispositivo activo» según el MDR y el IVDR
Según el MDR (Artículo 2, párrafo 4), un dispositivo médico activo se define como:
“Todo dispositivo médico cuyo funcionamiento depende de una fuente de energía distinta a la generada directamente por el cuerpo humano o por la gravedad.”
El IVDR (Artículo 2, párrafo 5) adopta una definición similar para los diagnósticos in vitro activos, centrada en dispositivos que funcionan mediante fuentes de energía externas (eléctrica u otras).
⚙️ Características de un dispositivo activo
✅ Requiere una fuente de energía externa (electricidad, batería, gas, aire comprimido).
✅ Convierte activamente la energía o la utiliza para su función.
✅ Realiza funciones de diagnóstico, terapia o monitoreo.
✅ Influye directamente en el estado del paciente o procesa muestras biológicas.
🚫 No se considera dispositivo activo:
❌ Productos que funcionan únicamente de forma mecánica o por gravedad (por ejemplo, sillas de ruedas no motorizadas, bisturíes simples, vendas).
❌ Dispositivos pasivos que no requieren fuente de energía externa.
🧪 Ejemplos de dispositivos activos
Según el MDR:
- Marcapasos
- Desfibriladores
- Bombas de infusión
- Respiradores
- Tensiómetros electrónicos
Según el IVDR:
- Analizadores PCR
- Equipos automatizados de análisis sanguíneo
- Microscopios electrónicos para análisis de laboratorio
- Software de procesamiento de datos diagnósticos
🧭 Clasificación de dispositivos activos según el MDR
Los dispositivos activos se clasifican por nivel de riesgo:
| Clase | Nivel de riesgo | Ejemplo |
|---|---|---|
| I | Bajo | Termómetros electrónicos |
| IIa | Medio | Instrumentos electroquirúrgicos, bombas de infusión |
| IIb | Alto | Respiradores, máquinas de diálisis |
| III | Muy alto | Marcapasos, desfibriladores implantables |
🛑 A mayor clase, mayores requisitos normativos.
- Clase I: Autocertificación por el fabricante
- Clases II y III: Evaluación por un organismo notificado y certificación CE obligatoria
📄 Requisitos reglamentarios para dispositivos activos
1. Documentación técnica
El fabricante debe presentar documentación detallada sobre:
- Seguridad eléctrica (norma IEC 60601 para productos sanitarios)
- Compatibilidad electromagnética (CEM)
- Seguridad mecánica (protección contra sobrecalentamiento, fallos de material)
- Biocompatibilidad y informes de ensayo
2. Requisitos para el software en dispositivos activos
Según el MDR, el software también puede clasificarse como dispositivo activo si:
- Apoya decisiones clínicas de diagnóstico o terapia
- Procesa datos médicos de forma activa (por ejemplo, mediante inteligencia artificial)
- Proporciona funciones de monitoreo de pacientes
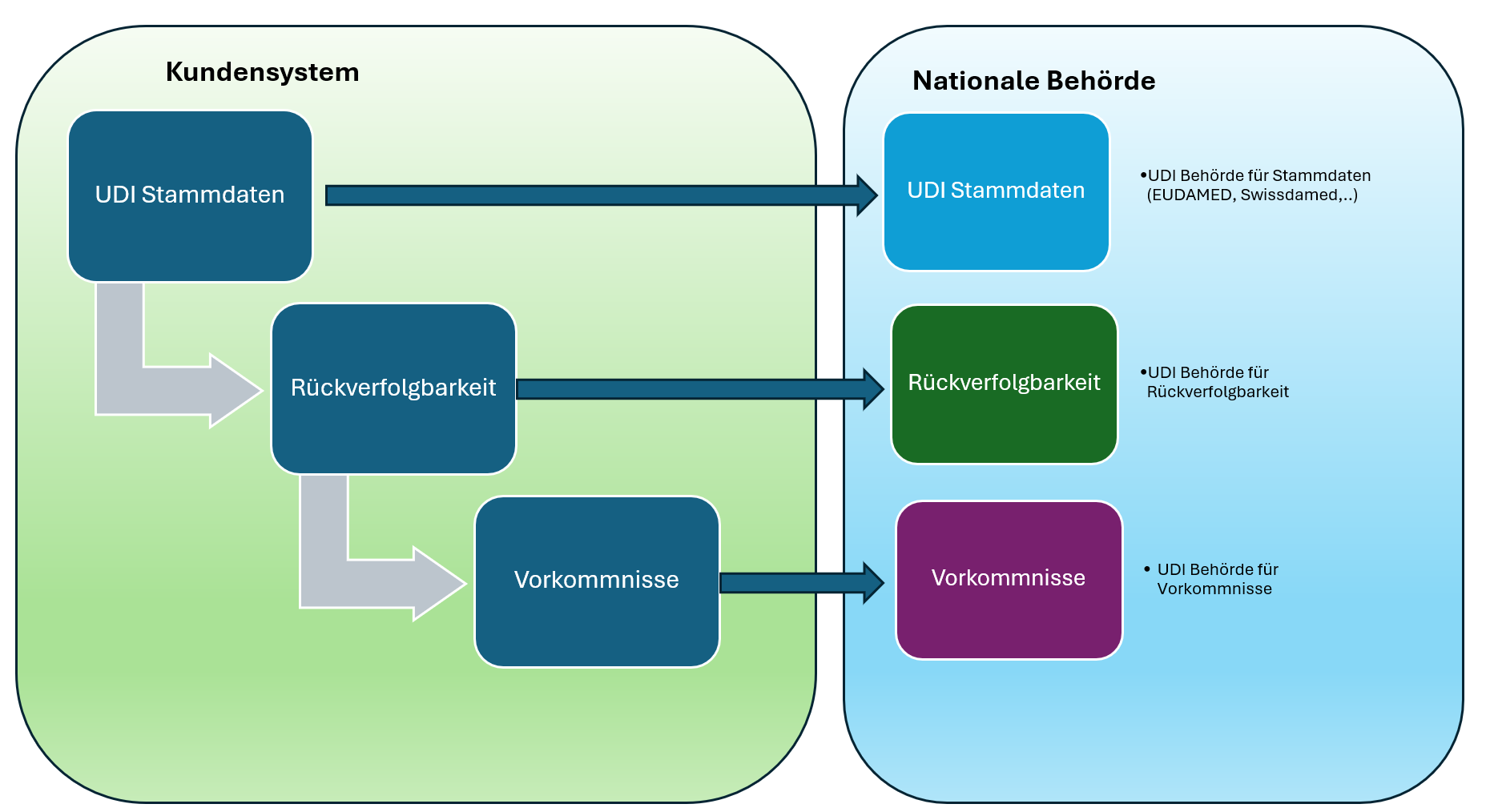
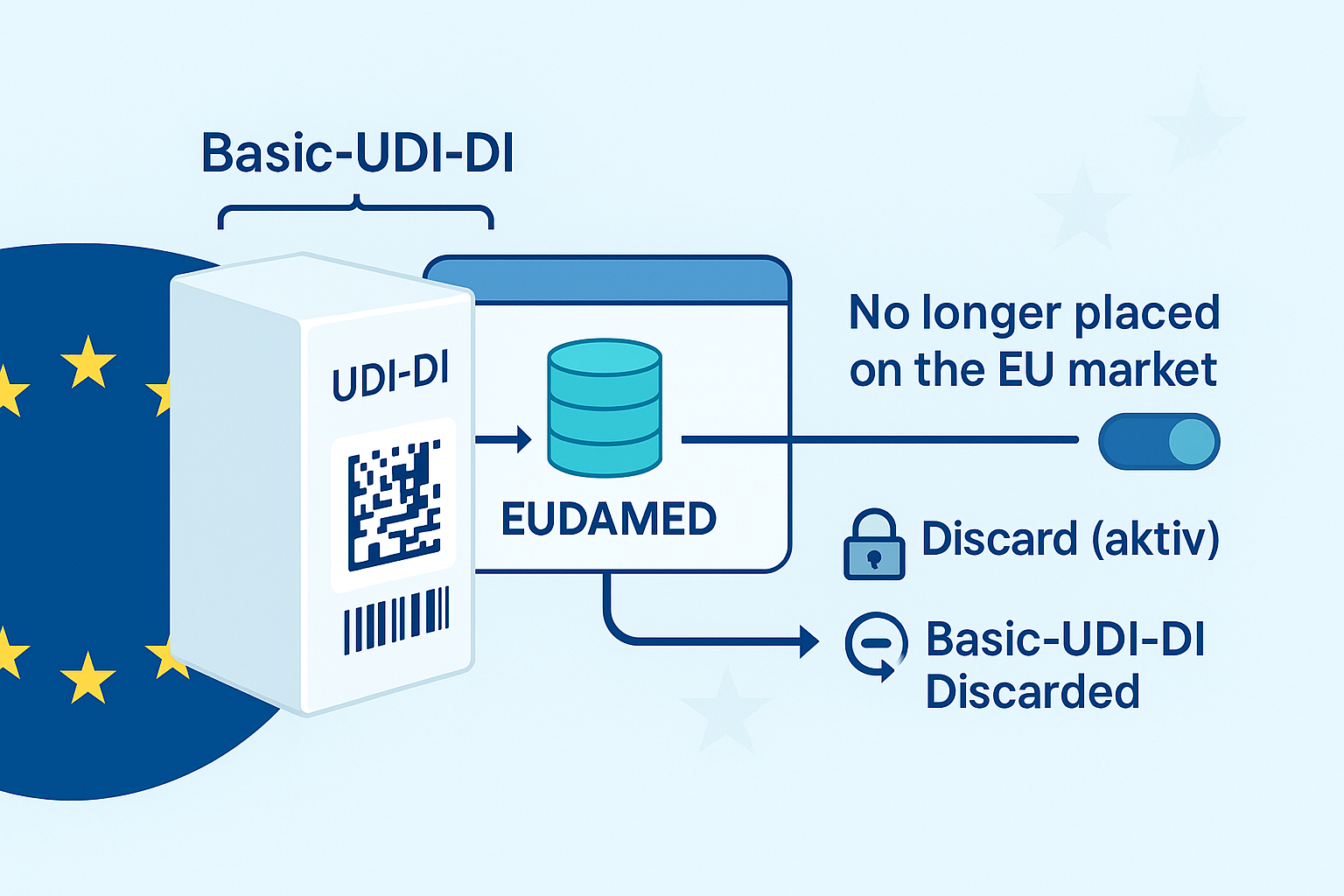
3. Trazabilidad y UDI
Los dispositivos activos deben estar identificados mediante un código UDI (Identificador Único de Dispositivo), que debe registrarse en la base de datos EUDAMED.
Esto mejora la trazabilidad y facilita la vigilancia del mercado.
✅ Conclusión
Un dispositivo activo es aquel que requiere una fuente de energía externa para funcionar y que influye de forma activa en el paciente o en procesos diagnósticos.
Estos productos están sujetos a estrictos requisitos normativos bajo el MDR y el IVDR.
Los fabricantes deben prestar especial atención a la clasificación, documentación técnica y certificación CE para garantizar el cumplimiento con la normativa europea vigente.





Related Posts