El registro UDI en EUDAMED

Dominar el registro UDI en EUDAMED: ¿por dónde empezar y cómo superar las incertidumbres? El registro de productos sanitarios en la base de datos europea EUDAMED parece para muchos fabricantes…

Dominar el registro UDI en EUDAMED: ¿por dónde empezar y cómo superar las incertidumbres? El registro de productos sanitarios en la base de datos europea EUDAMED parece para muchos fabricantes…

Global Submission Portal: Ahora también notificaciones MIR (EUDAMED Vigilance) Por fin: Capture, valide y envíe los Informes de Incidentes del Fabricante (MIR) de la UE de forma centralizada y en…

Regularia 2026 el 3 de marzo en el Ayuntamiento de Tuttlingen El programa ya está online – visite a Europe IT Consulting en el Stand 12 El 3 de…

¡Feliz Navidad y un buen comienzo del año 2026! Un año intenso llega a su fin, con muchos proyectos en torno a UDI, EUDAMED, FDA GUDID y más. Junto con…
UDI Excel Cloud Validator de Europe IT Consulting GmbH ya está disponible en SAP® Store Al integrarse con SAP Business Technology Platform (SAP BTP), UDI Excel Cloud Validator de Europe…
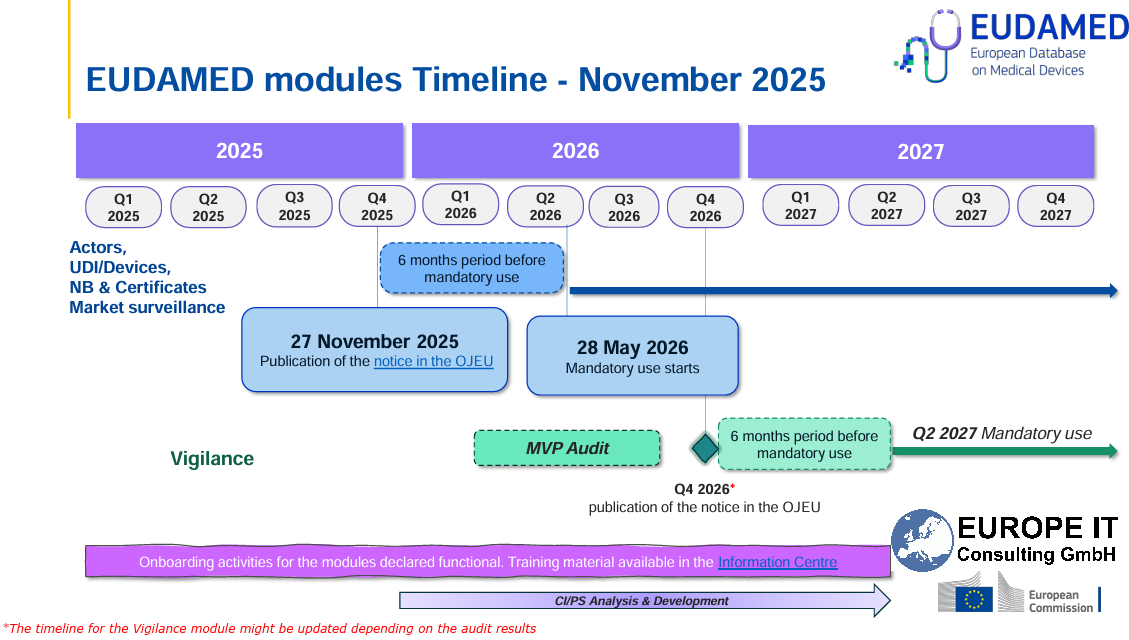
EUDAMED: Cuatro módulos obligatorios a partir del 28 de mayo de 2026 on la publicación de una nueva Decisión de Ejecución en el Diario Oficial de la Unión Europea el…
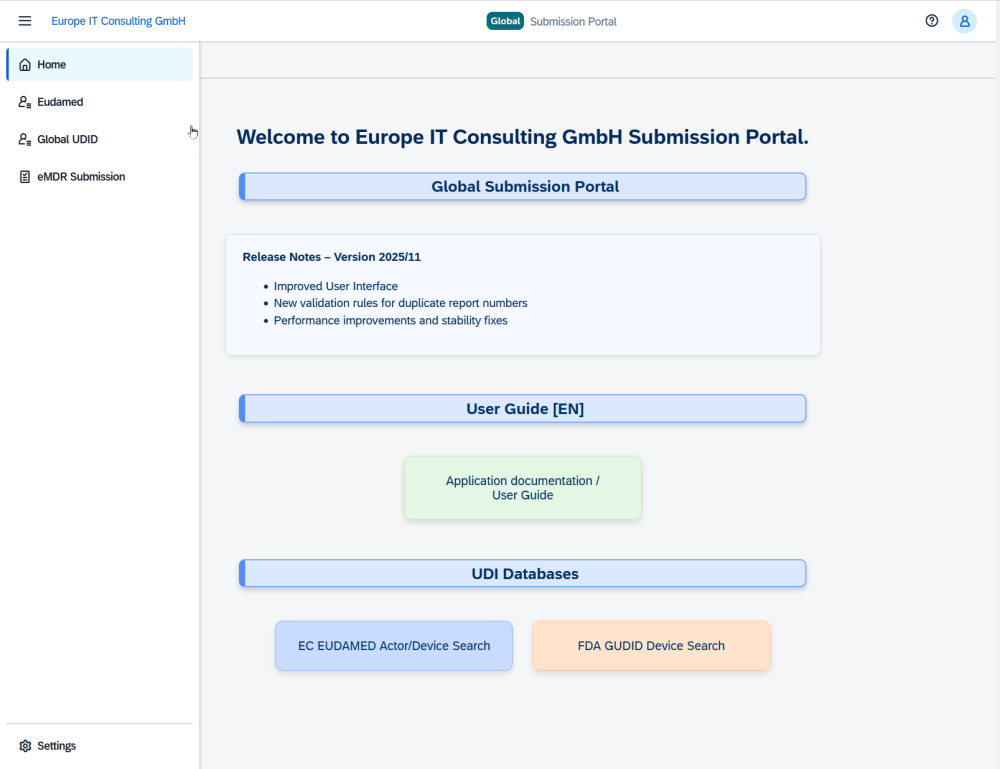
Europe IT Consulting presenta el Global Submission Portal con un enfoque en FDA eMDR Nueva plataforma en la nube que combina eMDR, GUDID y EUDAMED en un único sistema Con…

Reserve la fecha: regularia 2026 – Europe IT Consulting estará presente El 3 de marzo de 2026 tendrá lugar por primera vez en la Stadthalle Tuttlingen la regularia, el nuevo…

Lo que los fabricantes de lentes de contacto deben saber ahora sobre el Master UDI-DI A finales de agosto de 2025, el Medical Device Coordination Group (MDCG) publicó la versión…
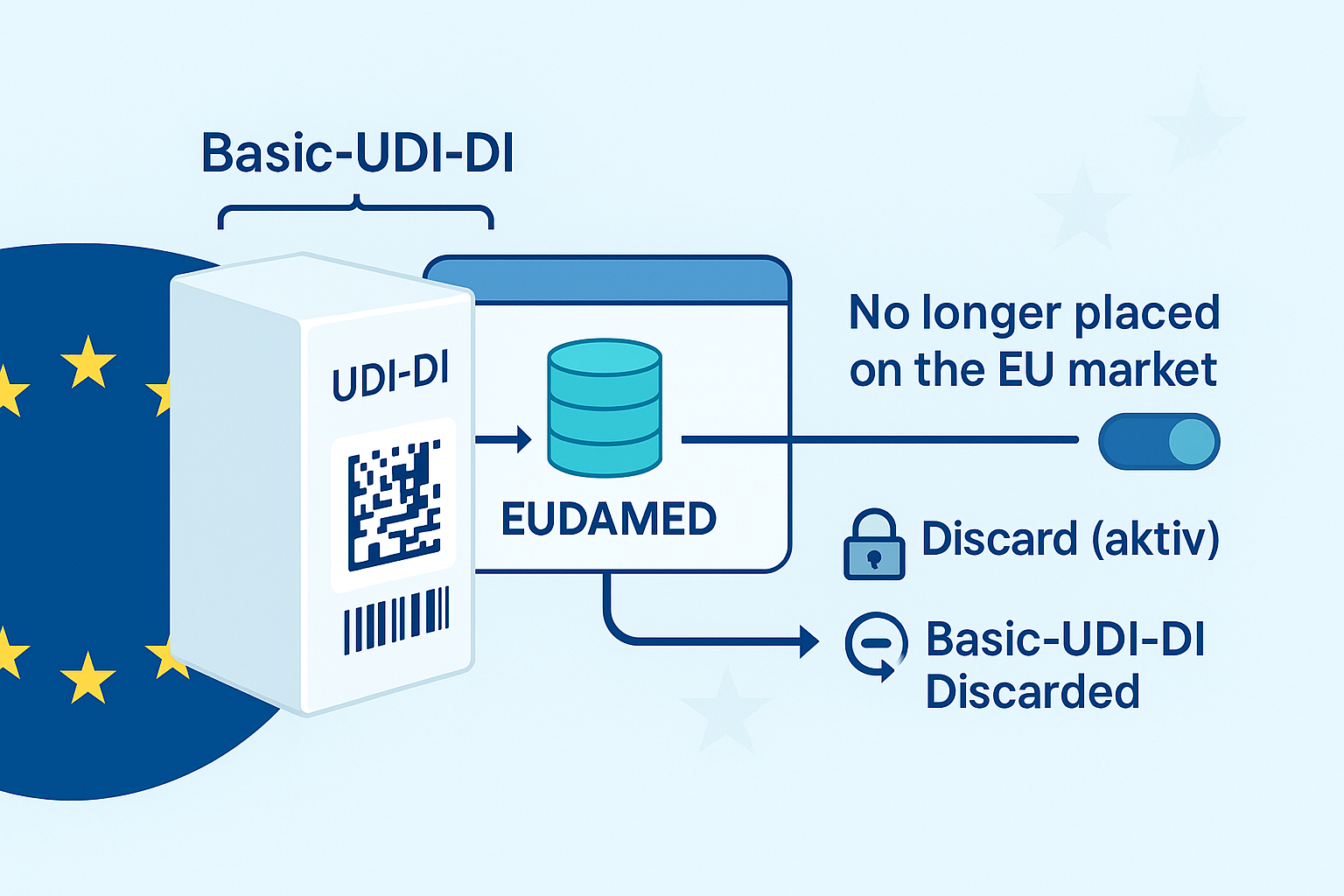
UDI-DI básico en escenarios de transición: ¿Puede un BUDI estar “vacío”? 1. ¿Puede existir un UDI-DI básico (transitorio) sin UDI-DI(s) asociado (s)? No , en EUDAMED, un UDI-DI básico no…