
Global Submission Portal: Ahora también notificaciones MIR (EUDAMED Vigilance)
Por fin: Capture, valide y envíe los Informes de Incidentes del Fabricante (MIR) de la UE de forma centralizada y en un solo flujo de trabajo.
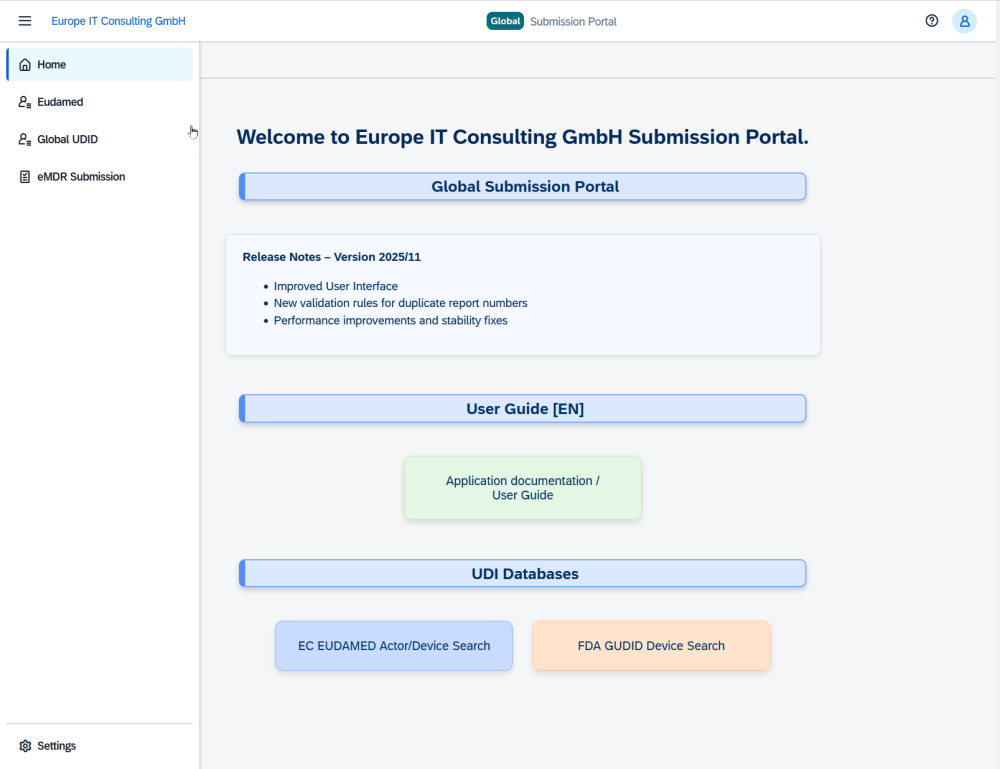
El Global Submission Portal pasa al siguiente nivel: tras el exitoso lanzamiento con FDA eMDR y envíos UDI, ahora incorporamos EUDAMED Vigilance. Esto significa que los Informes de Incidentes del Fabricante (MIR) de la UE ya se pueden gestionar con la misma eficiencia y seguridad que el resto de envíos: sin cambios de plataforma y sin caos.
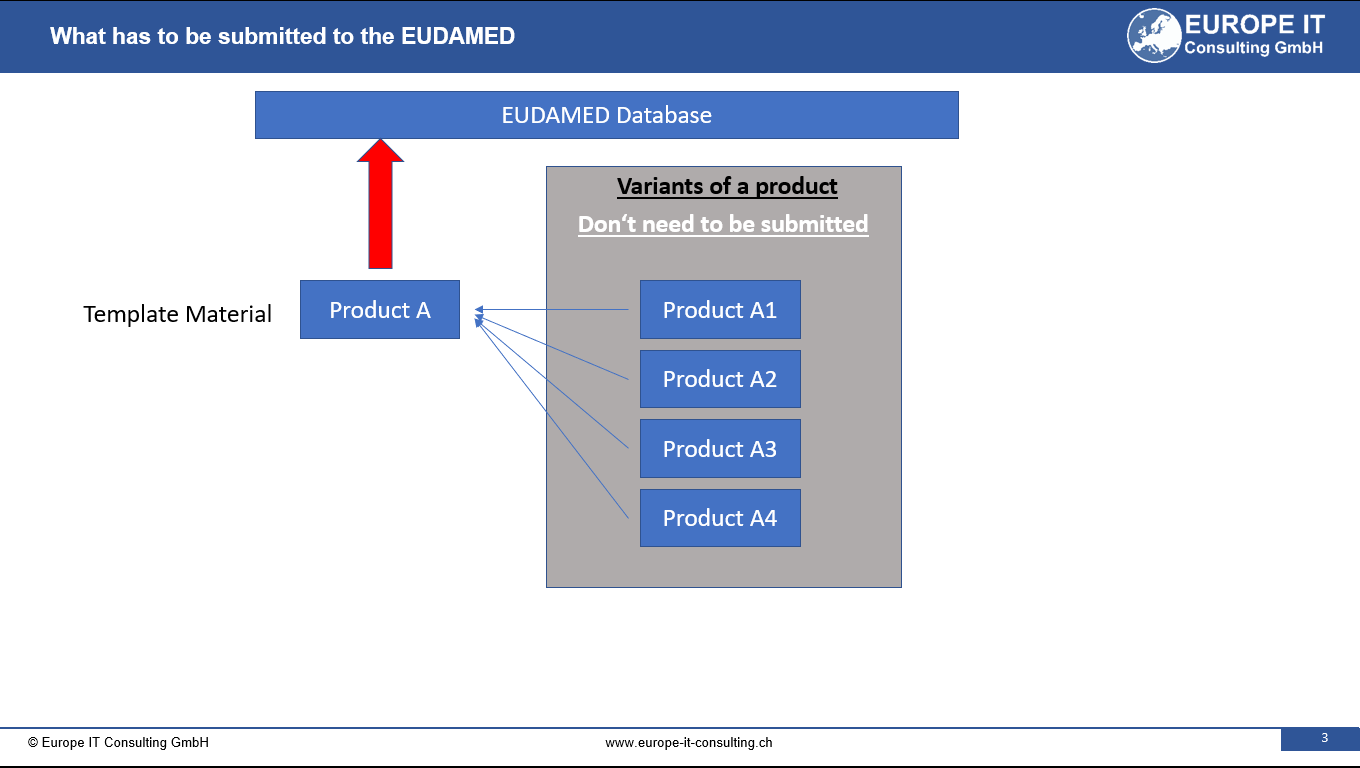
De la FDA a EUDAMED – Una plataforma, todos los envíos
En noviembre lanzamos el Global Submission Portal con un objetivo claro: acabar con la presión de los plazos, la propensión a errores y las soluciones aisladas. FDA eMDR, FDA GUDID, EUDAMED UDI: todo en un solo sistema, automatizado de principio a fin. Ahora cerramos el círculo: EUDAMED Vigilance (MIR) ya está disponible. Así, los clientes pueden gestionar sus obligaciones de notificación en la UE con la misma consistencia y control que sus envíos a EE. UU.
Por qué el MIR solía ser un dolor de cabeza (y cómo lo cambiamos)
Cualquiera que haya gestionado una notificación MIR conoce el problema: recopilar datos de tres fuentes distintas, teclear manualmente en formularios, preguntar el estado por correo electrónico y el caos de las hojas de cálculo. ¿El resultado? Falta de transparencia, retrasos y alto riesgo de errores. El Global Submission Portal pone fin a esto.
Así funciona el MIR ahora: sencillo, seguro y trazable
- Plantilla Excel en lugar de improvisar
Capture todos los datos relevantes de forma estructurada; se acabaron las dudas sobre dónde va cada dato. - Validación automática
El sistema comprueba la integridad y la plausibilidad antes del envío, detectando errores antes de que salgan caros. - Seguimiento de estado transparente
Cada envío pasa por etapas de estado claras (Uploaded → Processing → Success/Failed). Adiós a la incertidumbre de «¿Se habrá enviado realmente?». - Centro de descargas para todo
Archivos de resultados, protocolos y acuses de recibo: todo recopilado en un ZIP o individualmente, disponible para descargar en cualquier momento.
Una plataforma. Compliance global. Listo.
Con FDA eMDR, GUDID, EUDAMED UDI y ahora EUDAMED Vigilance (MIR), el portal cubre los flujos de trabajo regulatorios más críticos en una solución unificada. Sin saltar de una herramienta a otra. Sin duplicar trabajo. Solo un sistema.
Envíe su solicitud directamente aquí: https://udi.europe-it-services.com/



Related Posts