
Reserve la fecha: regularia 2026 – Europe IT Consulting estará presente
El 3 de marzo de 2026 tendrá lugar por primera vez en la Stadthalle Tuttlingen la regularia, el nuevo foro regulatorio para el sector de tecnología médica. El evento reúne a expertos y responsables de la toma de decisiones de asuntos regulatorios, gestión de calidad, política e industria para debatir soluciones prácticas sobre MDR, autorizaciones internacionales, el AI Act, conformidad de materiales y sostenibilidad. Europe IT Consulting estará presente in situ como expositor.
¿Qué es regularia?
regularia está organizada por MedicalMountains en Tuttlingen y se está consolidando como un foro regulatorio central para el sector de tecnología médica.
El programa de jornada completa el 03.03.2026 en la Stadthalle Tuttlingen ofrece:
- Discurso de bienvenida por parte de MedicalMountains
- Inauguración oficial por la Ministra Federal de Sanidad
- Varias sesiones técnicas paralelas en dos escenarios
- Debate final en mesa redonda con representantes de la política y la economía
Público objetivo:
- Directores generales y directivos
- Especialistas y responsables de asuntos regulatorios, gestión de calidad y áreas afines
- Proveedores de servicios, laboratorios y organismos notificados (exposición paralela)
Temas principales de regularia 2026
El programa publicado se divide en varios bloques temáticos en dos escenarios (“Blue Stage” y “Green Stage”):
- MDR y requisitos clínicos
- Experiencia con la implantación del MDR en la práctica diaria
- Registro en EUDAMED y gestión de incertidumbres
- PSUR entre las exigencias regulatorias y su aplicación práctica
- Evaluación clínica y seguridad con datos clínicos limitados
- Digitalización de RA y QM
- Rediseño de los procesos de RA con herramientas digitales
- Digitalización de procesos manuales en el área de producción (shopfloor)
- Documentación digital en RA, QM y técnica
- Identificación y análisis de cambios regulatorios con apoyo de IA
- Autorizaciones internacionales
- Armonización de los requisitos de calidad de EE. UU. (p. ej. QMSR)
- Estrategias de entrada en el mercado estadounidense en tiempos de incertidumbre
- Panorama de UKCA, UKRP y MDR en el Reino Unido
- Perspectivas sobre la legislación de productos sanitarios, por ejemplo en Arabia Saudí
- Conformidad de materiales y sostenibilidad / Green Deal
- Sostenibilidad y compliance como factor estratégico de competitividad
- Restricciones relativas a las PFAS y su impacto en la industria y la cadena de suministro
- Cambios en las normas pertinentes (entre otras, biocompatibilidad, microplásticos)
- Requisitos del Green Deal de la UE y su impacto concreto en las empresas de tecnología médica
- Casos prácticos sobre cómo las pymes de tecnología médica implementan la sostenibilidad
- Requisitos del Reglamento sobre baterías para los productos sanitarios
- Ciberseguridad / Software / AI Act
- Experiencia de un organismo notificado con productos sanitarios basados en IA
- Interacción entre el AI Act y el MDR
- Validación y autorización de sistemas que utilizan modelos de lenguaje
- Requisitos de ciberseguridad más allá de la gestión clásica de riesgos
- Cuestiones de responsabilidad por productos en el entorno digital
De este modo, regularia cubre un amplio espectro: desde el cumplimiento clásico del MDR y los mercados internacionales hasta la IA, la ciberseguridad y la sostenibilidad.
Por qué regularia es relevante para responsables de UDI y de datos
Para muchos fabricantes, el periodo hasta 2026 está marcado por:
- Implantación de EUDAMED y un uso cada vez más obligatorio,
- Swissdamed UDI Devices y particularidades nacionales,
- requisitos paralelos de FDA GUDID, UKCA y otros mercados,
- así como una creciente presión para mejorar la calidad de los datos, los procesos y la automatización.
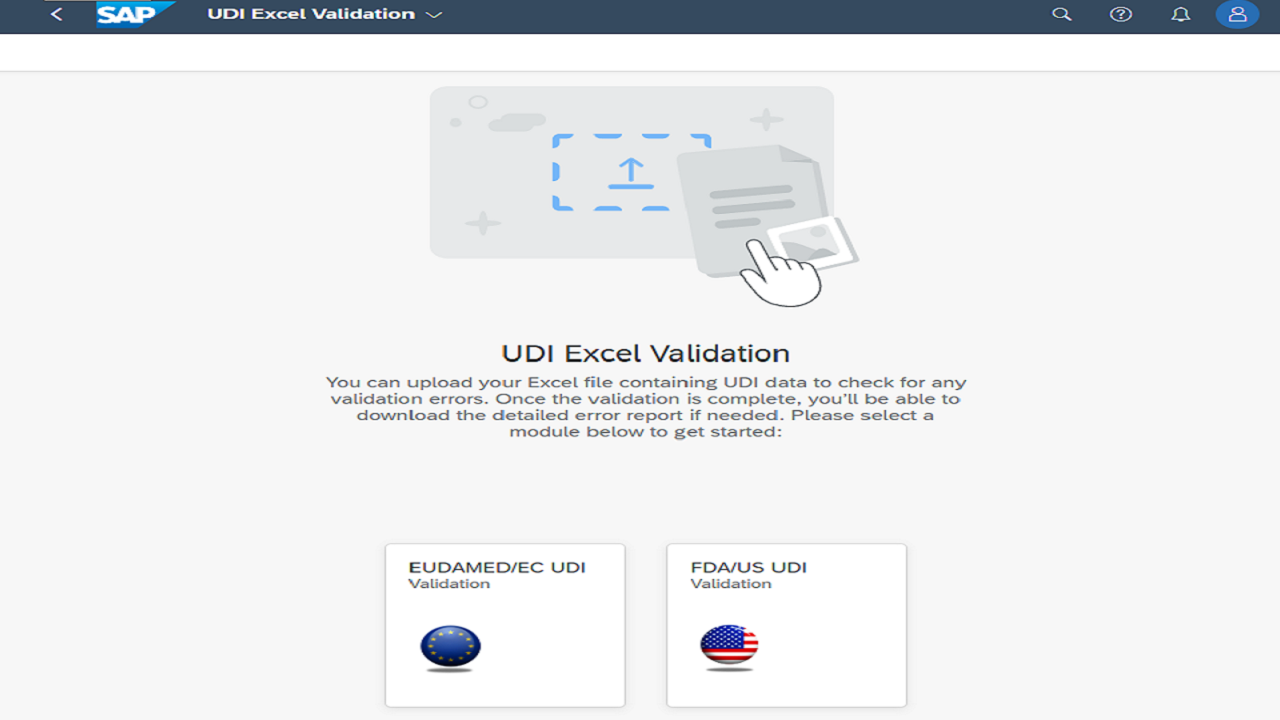
Precisamente aquí es donde Europe IT Consulting aporta valor con la Global UDI Data Management Solution (GUDI) y servicios complementarios: desde plantillas Excel y herramientas de validación hasta flujos de trabajo UDI integrados en SAP.
regularia ofrece el marco ideal para:
- obtener una visión compacta de los desarrollos regulatorios actuales,
- llevarse buenas prácticas para proyectos de UDI y digitalización, y
- debatir cuestiones concretas con expertos y proveedores de servicios.
¡Encuéntrenos en regularia!
Para nuestros clientes y socios, regularia es una oportunidad ideal para una reunión personal. Estaremos encantados de coordinar citas en torno al evento —directamente en Tuttlingen o virtualmente después— para hablar juntos sobre:
- hojas de ruta UDI para EUDAMED, Swissdamed, FDA y otras autoridades,
- modelos de datos y procesos en entornos SAP o no SAP,
- proyectos concretos en los ámbitos de UDI global, validación de datos o interfaces.
Información oficial e inscripción: regularia
¡Esperamos poder intercambiar con usted en Tuttlingen!








Related Posts