¿Deben registrarse en EUDAMED productos hechos a medida (Custom-made devices /CMD)? ¿Y qué pasa con los casos de vigilancia?
¿Qué son los productos hechos a medida según MDR? Por favor, lea también nuestro artículo Pedido especial de acuerdo con MDR (2017/745)
La cuestión de si los «dispositivos hechos a medida» deben registrarse en EUDAMED nos llega con frecuencia y también causa cierta confusión con respecto a los casos de vigilancia. Por lo tanto, nos gustaría proporcionar claridad en nuestra noticia de hoy y abordar los siguientes temas:
-
¿Cuáles son las obligaciones de los fabricantes de Medtech de productos a medida?
-
¿Deben registrarse como UDI?
-
¿Deben informarse los datos de Viligance?
¿Cuáles son las obligaciones básicas de los productos a medida?
Estas obligaciones se aplican EN SU TOTALIDAD:
- Marcado CE y evaluación de la conformidad según MDR
- Crear y mantener actualizada la documentación técnica
- Realizar una evaluación clínica (adaptada a la producción individual)
- Establecer la vigilancia posterior al mercado
- Obligaciones de vigilancia en caso de incidentes graves
- Sistema de gestión de riesgos según ISO 14971
Estas obligaciones no se aplican a los CMD:
- Activar el organismo notificado (excepto para los implantes de clase III)
- Ensayos clínicos (por lo general)
- Sistema UDI y registro de dispositivos EUDAMED
¿Los productos personalizados deben registrarse como UDI?
Respuesta clara: NO
Fundamento jurídico:
- MDR art. 27(1): El sistema UDI se aplica a «… que no sean productos personalizados…»
- MDR art. 29(4): Obligación de registro en EUDAMED expresamente excluido para CMDs
¿Qué significa esto en la práctica?
| Aspecto | Productos a medida | Productos en serie |
|---|---|---|
| UDI-DI asignado | No es necesario | Obligatorio |
| UDI-PI en el producto | No es necesario | Obligatorio |
| Registro de dispositivos EUDAMED | No es necesario | Obligatorio |
| Identificación propia del producto | Recomendado (interno) | Plus UDI |
Consejo práctico:
Incluso sin la obligación de UDI, debe establecer una identificación interna del producto , lo que facilita enormemente los mensajes de Vigilance y la vigilancia posterior al mercado.
¿Deben notificarse los datos de Vigilance?
Respuesta clara: ¡SÍ, en su totalidad!
Fundamento jurídico:
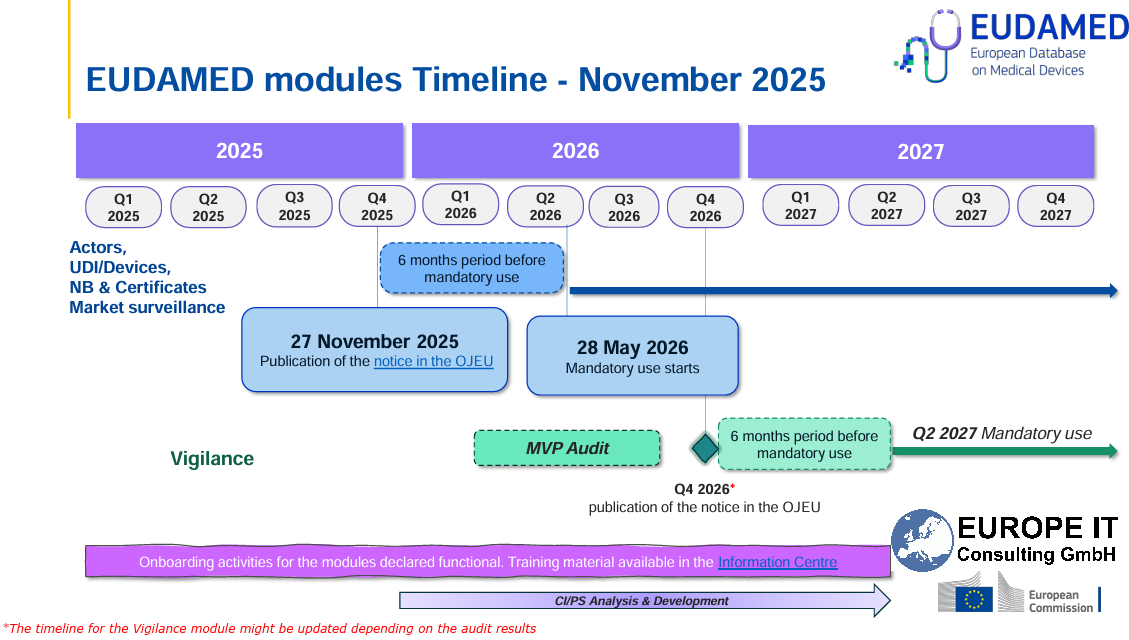
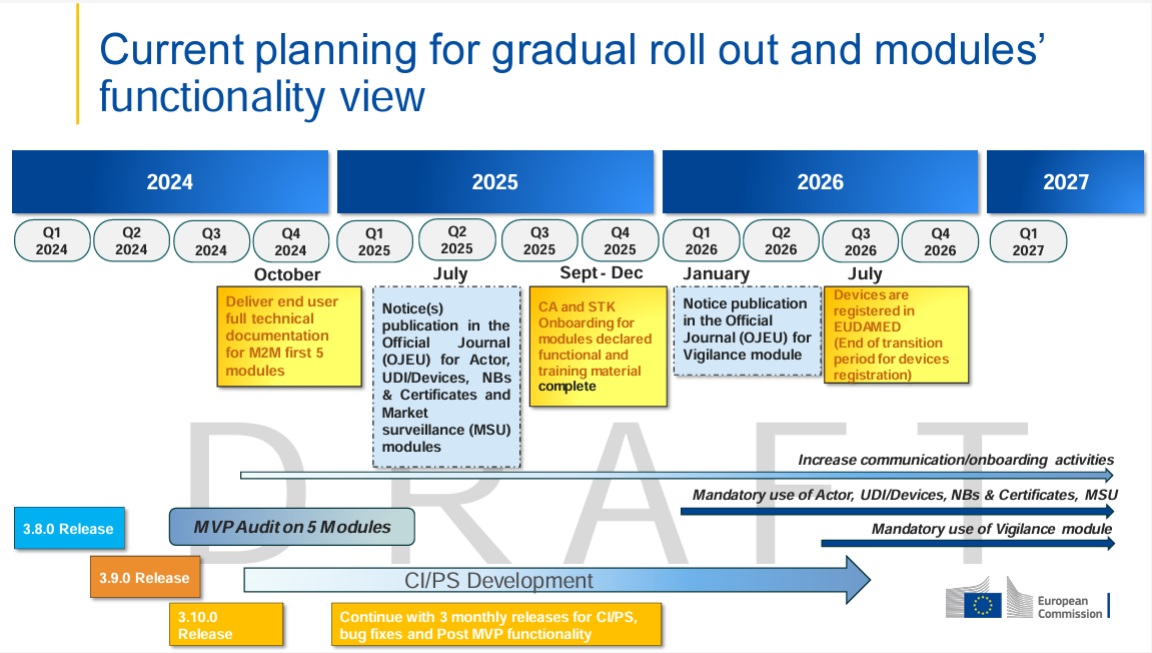
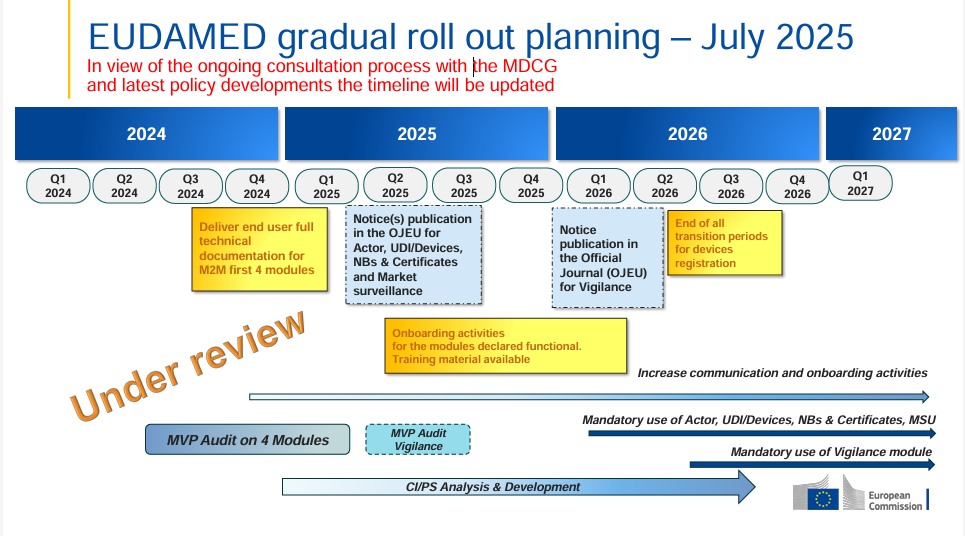
- MDCG 2024-11, Q6: los fabricantes que comercializan exclusivamente productos a medida deben registrarse en el módulo Act para poder informar, por ejemplo, de un incidente grave.
- MDCG 2021-3 (Custom-made Q&A), párr. 8: «With the absence of stated exceptions, CMD manufacturers must meet nearly all of the MDR requirements…» incl. Notificaciones de Vigilancia de conformidad con el art. 87(1).
Las obligaciones de vigilancia se aplican tanto a los CMD como a los productos en serie:
Obligaciones de información en detalle:
Incidentes graves (MIR)
- Plazo de notificación: 15 días naturales después del conocimiento
- Dónde: Módulo EUDAMED Vigilance (después del despliegue) o nacional
- Qué: muerte, deterioro grave de la salud, peligro
Informar de tendencias
- Cuándo: En caso de acumulación de incidentes no graves
- Evaluación: Se requiere monitoreo continuo
Acciones correctivas de seguridad en el campo (FSCA)
- En: devoluciones de llamada, advertencias, actualizaciones de software
- Publicación: Sobre EUDAMED (Aviso de seguridad en el campo)
Particularidad: se requiere registro de Actor
¡No es posible informar de Vigilance sin SRN!
- Los fabricantes de CMD solo deben registrarse como actor en EUDAMED para fines de vigilancia
- Momento crítico: registro ANTES del primer mensaje
- Único: SRN permanece para todos los mensajes futuros







Related Posts