Módulo de dispositivos UDI en directo
Swissmedic amplía la base de datos nacional de productos sanitarios con una funcionalidad centralizada.
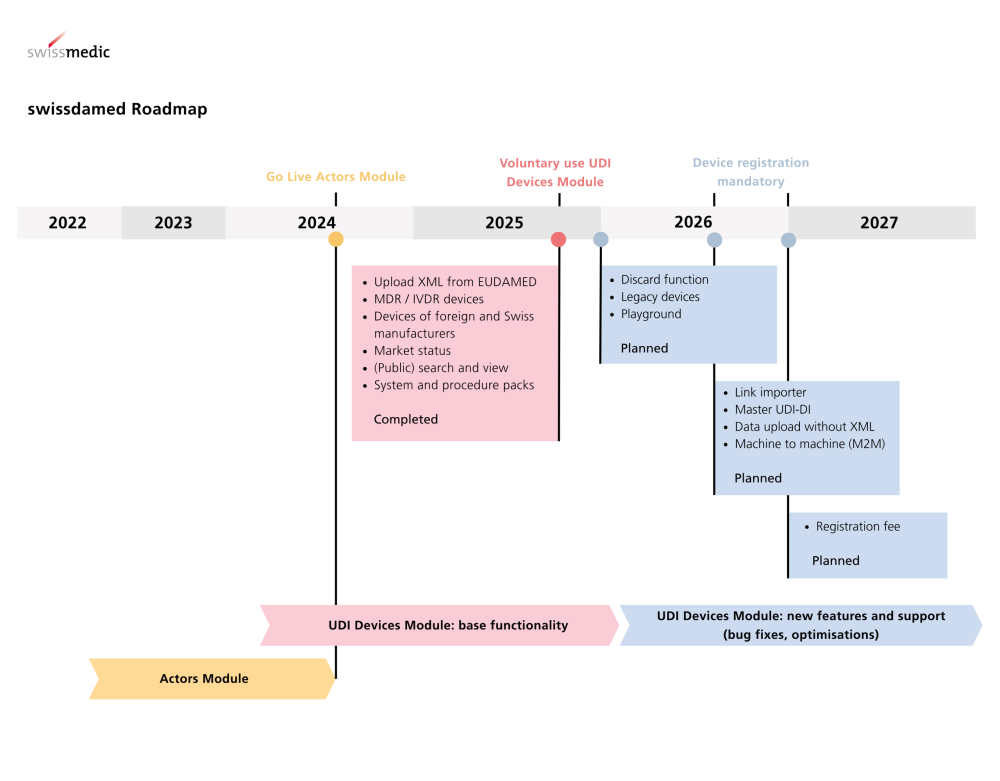
El módulo de dispositivos UDI en swissdamed está en vivo desde el 18 de agosto de 2025. A partir de ahora, se pueden registrar productos médicos, productos de diagnóstico in vitro, así como sistemas y paquetes de procedimientos. El registro es inicialmente voluntario, pero será obligatorio a partir del 1 de julio de 2026 ; para la mayoría de los productos se aplica un período transitorio hasta finales de 2026.
Para los productos con obligación de notificación (incidentes graves, FSCA, tendencias) no hay período de transición : la obligación de registro entra en vigor el 1 de julio de 2026.
Resumen
-
Nuevo: el módulo de dispositivos UDI permite el registro de productos en swissdamed.
-
Obligatorio: Registro a partir del01.07.2026, generalmente con período transitorio hasta el 31.12.2026.
-
Sin periodo transitorio: Para productos de notificación obligatoria (incidentes graves, FSCA, tendencias).
-
Antecedentes: swissdamed funciona desde agosto de 2024 ; el módulo Actors ha estado activo desde el inicio.
¿Qué hay de nuevo?
El nuevo módulo complementa swissdamed con el registro y la gestión de dispositivos médicos, IVDs y paquetes de sistemas/procedimientos, lo que supone un aumento significativo de la transparencia para el mercado suizo.
Fechas importantes y disposiciones transitorias
-
A partir de ahora: es posible registrarse voluntariamente .
-
A partir del 1 de julio de 2026: Registro obligatorio para los productos comercializados en Suiza. Período transitorio hasta el 31 de diciembre de 2026.
-
No hay período transitorio para los productos con obligación de notificación (incidentes graves, FSCA, tendencias) – Obligatorio a partir del 1 de julio de 2026.
Agentes económicos afectados
Las obligaciones de registro se aplican, entre otros, a los fabricantes, agentesy ensambladores suizos de paquetes de sistemas/procedimientos.
Importancia para el mercado
Con el registro del producto, la transparencia del mercadoaumenta; la estrategia de despliegue paso a paso permite a los actores configurar los procesos a tiempo (módulo Actors desde el 08/2024, ahora dispositivos UDI).
¿Qué debería hacer ahora? (práctico)
-
Revisar datos del actor: Mantener el módulo Actors completo y actualizado (CHRN, derechos de usuario, mandatos).
-
Priorizar cartera: identificar todos los productos/IVDs/sistemas comercializados en CH; planificar primero los productos sujetos a notificación .
-
Asegurar la calidad de los datos: definir los datos maestros de UDI, las responsabilidades, los procesos de cambio y la evidencia (por ejemplo, referencias a FSCA/tendencias).
-
Preparación técnica: Decidir entre la carga XML (hoy el camino) y las opciones de escalado posteriores (plantillas/automatización).
-
Fijar cronograma: hitos internos hasta el 01/07/2026 (cargas piloto, revisiones, aprobaciones).
Más información
Encontrará todos los detalles sobre las obligaciones, los horarios, los fundamentos técnicos y otras funcionalidades en la documentación de Swissmedic; puede ponerse en contacto con swissdamed aquí: swissdamed.ch.
Aproveche nuestra experiencia para un inicio exitoso en swissdamed.








Related Posts