
La plataforma Swissdamed sigue tomando forma y, con ella, las obligaciones reglamentarias para los fabricantes y comercializadores de productos médicos en Suiza y Liechtenstein. Ahora se centra en un módulo central: el módulo de dispositivos UDI, que traerá consigo cambios de gran alcance para la industria de la tecnología médica a partir de 2026.
📌 ¿Qué cambia concretamente?
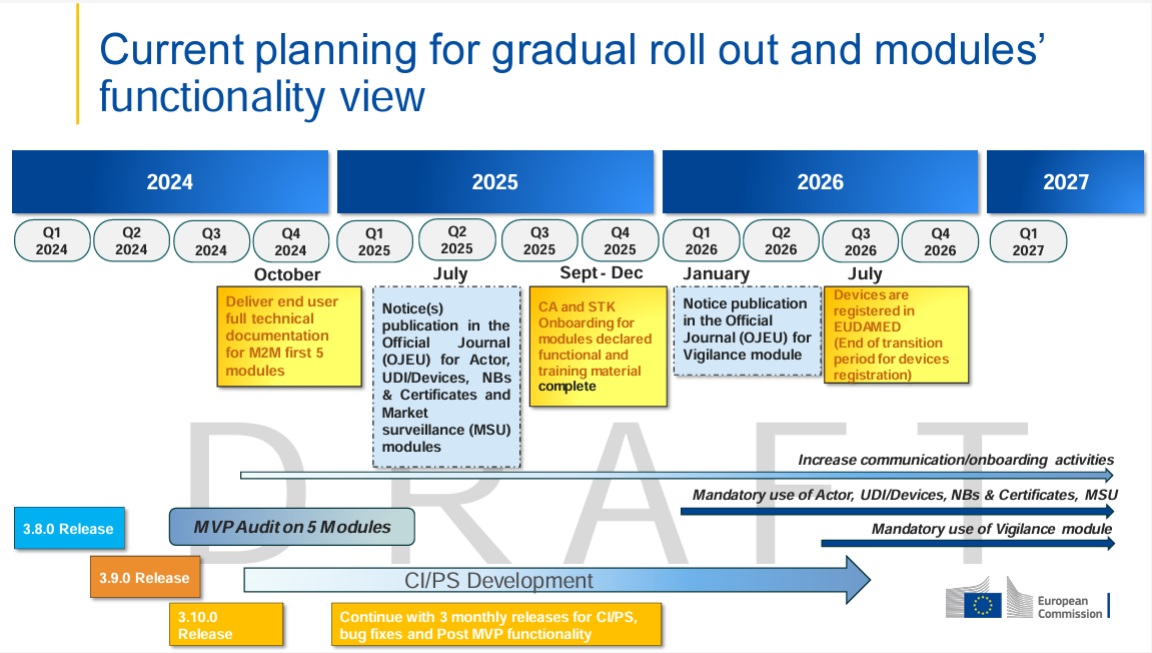
A partir del 1 de julio de 2026 , la obligación de registro para los UDI (Unique Device Identifiers) será obligatoria. Esta innovación afecta a todos los actores del sector de los productos sanitarios:
Obligación de registro para todos los productos:
- Todos los productos, sistemas y unidades de tratamiento deben registrarse en Swissdamed antes de su primera comercialización
- Esta obligación se aplica tanto a los productos comercializados en Suiza como en Liechtenstein
- El registro UDI se convierte en un requisito previo para la comercialización legal
⏳ La regulación transitoria ofrece seguridad de planificación
Se concede a las empresas un periodo transitorio hasta el 31 de diciembre de 2026. Este período de seis meses permite registrar posteriormente los productos existentes en Swissdamed y adaptar los procesos internos en consecuencia.
Aproveche este tiempo para:
- Registro sistemático de todos los productos sujetos a UDI
- Adaptación de los procesos internos de registro
- Formación de los empleados
- Integración técnica en sistemas existentes
⚠️ No hay fecha límite para las notificaciones de Vigilance: se necesita una acción inmediata
Excepción crítica: No se aplica ningún período transitorio en los siguientes casos: aquí entra en vigor la obligación de registro inmediato a partir del 1 de julio de 2026:
- Notificación de un incidente grave
- Acción correctiva de seguridad sobre el terreno (FSCA)
- Mensajes de tendencia
Estos casos de vigilancia requieren obligatoriamente un registro previo de los datos UDI afectados en Swissdamed. Encontrará más información sobre los informes de Vigilance en: swissmedic.ch > Productos sanitarios > Informar de incidentes y FSCA (Vigilance)
🔍 Normas especiales para «dispositivos antiguos»
Se aplican regulaciones especiales a los productos que ya estaban en el mercado antes del 1 de julio de 2026. Swissmedic proporciona información detallada en una sección de preguntas frecuentes :
👉 swissmedic.ch > Productos sanitarios > swissdamed > Preguntas y respuestas
Funcionalidades 🔄 futuras
La búsqueda de UDI-DI y datos de dispositivos médicos dentro de la base de datos de Swissdamed está anunciada para una futura versión, pero aún no está disponible. Esta función simplificará aún más el trabajo con la plataforma y aumentará la eficiencia en la búsqueda de productos.
Recomendaciones 💡 estratégicas para empresas
Comience ahora con la preparación:
- Inventario de todos los productos sujetos a UDI
- Evaluación de los procesos de Vigilancia existentes
- Evaluación técnica para la integración de sistemas
- Calendario de registro paso a paso
Minimización de riesgos a través de una planificación temprana: un enfoque proactivo ayuda a minimizar los riesgos de cumplimiento y a evitar posibles interrupciones del mercado.
Su socio para la implementación de UDI
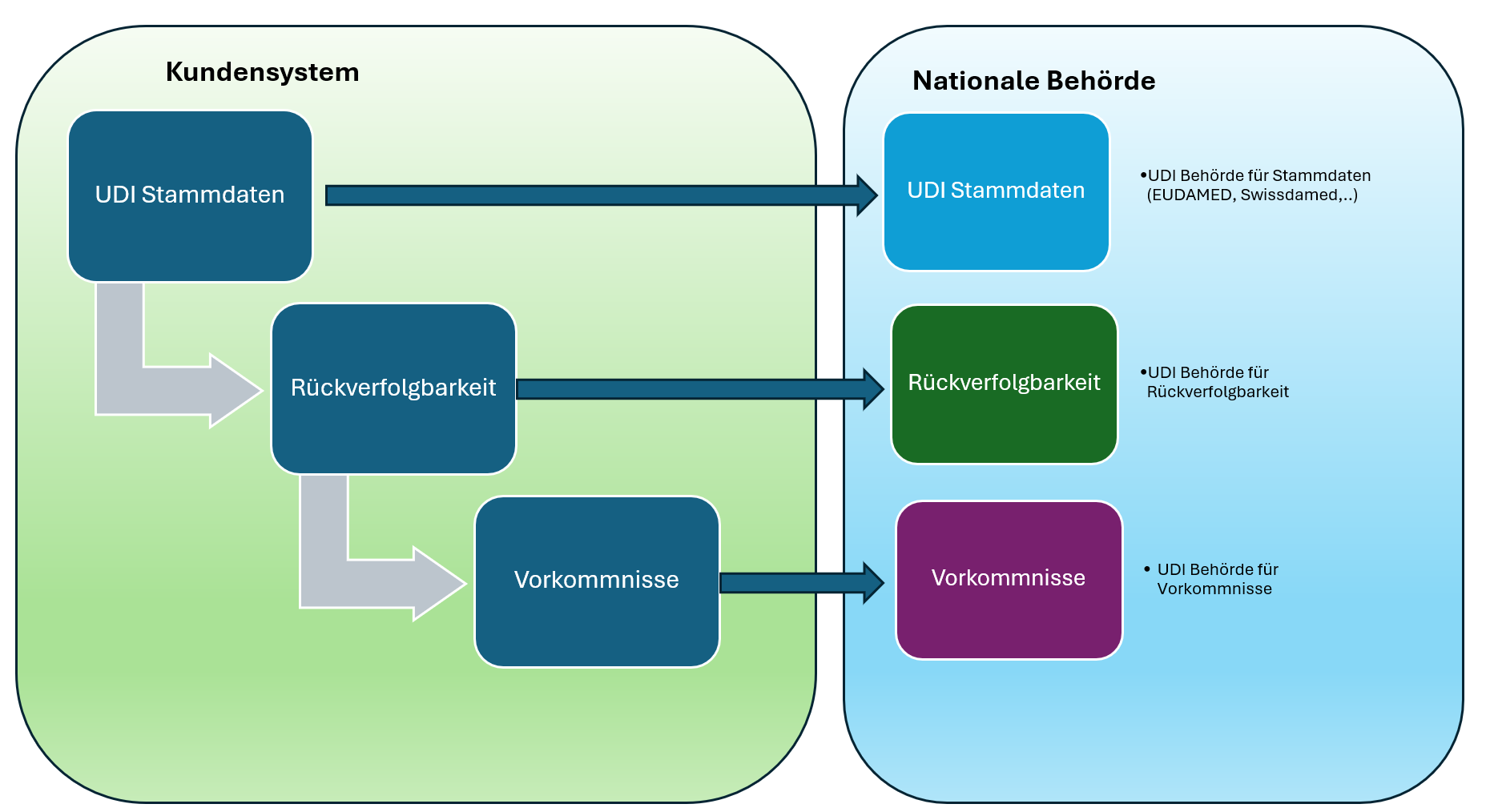
Europe IT Consulting estará encantada de ayudarle con el registro estructurado de UDI, la conversión y la transmisión de datos, también para Swissdamed. Nuestra experiencia incluye:
- Integración técnica del sistema
- Conversión automatizada de datos
- Consultoría de cumplimiento
- Optimización del proceso
- Puede encontrar más información sobre Swissdamed aquí: Swissdamed UDI
Para preguntas específicas sobre la implementación en su empresa, póngase en contacto con nuestro equipo de expertos.
Ponte en contacto con nosotros
Manténgase informado sobre los nuevos desarrollos de la plataforma Swissdamed y los cambios regulatorios en el sector de la tecnología médica.








Related Posts