La solución inteligente para la gestión de datos UDI compatible
Transformar los desafíos regulatorios en ventajas competitivas
Tu problema es nuestra solución
En un momento de crecientes requisitos reglamentarios, los fabricantes de dispositivos médicos se enfrentan a un desafío crucial: ¿cómo puede cumplir de manera eficiente los complejos requisitos de EUDAMED sin desperdiciar recursos valiosos?
Nuestra plantilla de Excel es el primer paso, desarrollada por expertos en UDI para empresas que valoran la eficiencia y el 100% de cumplimiento.
Por favor rellene el formulario para solicitar una cotización
Echa un vistazo a nuestra potente plantilla de Excel/
Demostración práctica: lo fácil que es trabajar con nuestra plantilla de Excel
La plantilla Excel EUDAMED MDR/IVDR de un vistazo:
Registros completos para todos los datos UDI requeridos:
- Pestaña UDI-DI básica:
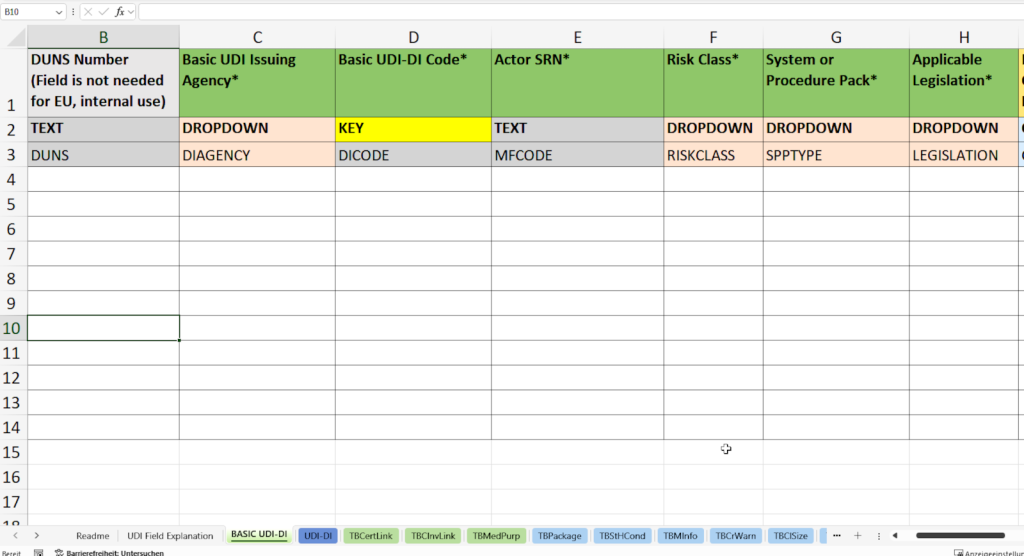 En esta pestaña se introducen todos los datos maestros necesarios para la identificación única de su familia de productos de acuerdo con las especificaciones de la base de datos EUDAMED (European Database on Medical Devices).
En esta pestaña se introducen todos los datos maestros necesarios para la identificación única de su familia de productos de acuerdo con las especificaciones de la base de datos EUDAMED (European Database on Medical Devices).
- Asignación y documentación del UDI-DI Básico (Código UDI-DI Básico) de acuerdo con las especificaciones del organismo emisor responsable (Organismo Emisor de UDI Básico), por ejemplo, GS1, HIBCC o ICCBBA.
- Registrar el SRN (Número de Registro Único, SRN del Actor) de su empresa o el SRN del Representante Autorizado de la UE.
- Asignación de la clase de riesgo como clase I, IIa, IIb o III según las especificaciones MDR/IVDR.
- Selección del tipo de producto (sistema o paquete de procedimientos)
- Determinación de la legislación aplicable (Legislación Aplicable) – Reglamento de Dispositivos Médicos (MDR) o Reglamento de Diagnóstico In Vitro (IVDR).
- Especificación de las propiedades específicas de IVDR, tales como: Diagnóstico complementario; Presencia de células/sustancias de origen microbiano; Pruebas cercanas al paciente; Pruebas de auto-paciente; Uso como instrumento, kit o para pruebas profesionales
- Identificación como dispositivo activo (Active device), con función de medición (Measuring function) o función de administración (Administer device).
- Indicación de si se trata de un instrumento quirúrgico reutilizable o de un dispositivo implantable.
- Especificación del tipo de dispositivo especial
- Registro del modelo de dispositivo y/o nombre del dispositivo.
- Indicación del uso de tejidos o células animales o componentes humanos (presencia de tejidos o células humanas).
Por favor rellene el formulario para solicitar una cotización
- Pestaña UDI-DI:
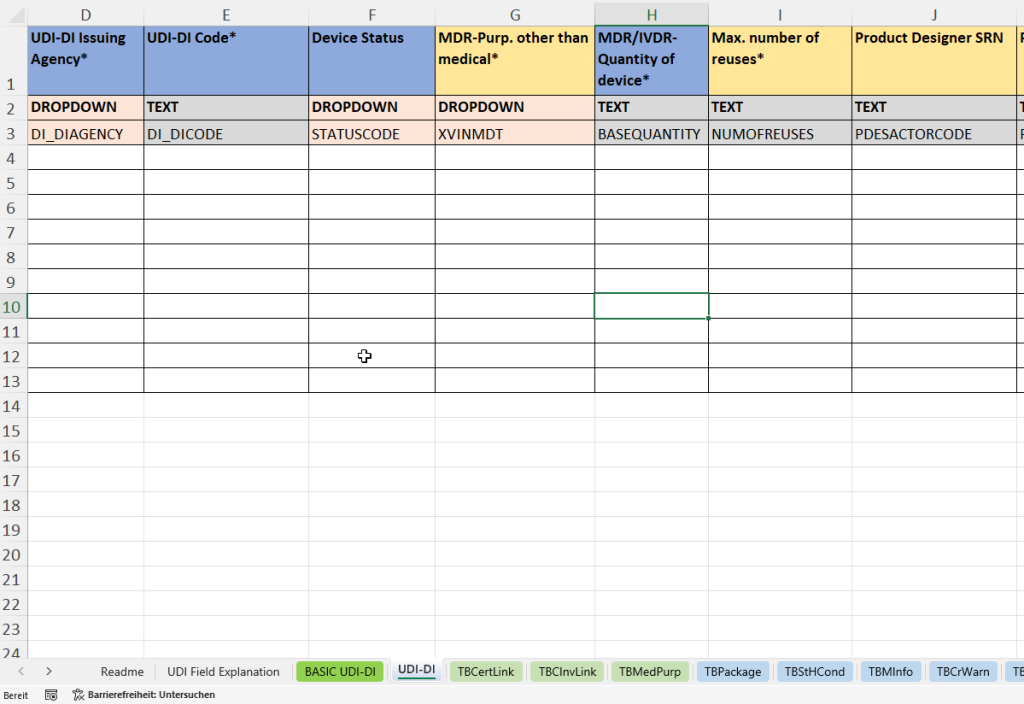 esta pestaña recopila todos los datos individuales relacionados con el producto necesarios para la identificación y trazabilidad únicas de un dispositivo médico específico. El UDI-DI (Identificación Única de Dispositivo – Device Identifier) es la clave principal para el registro de PRODUCTOS EN EUDAMED.
esta pestaña recopila todos los datos individuales relacionados con el producto necesarios para la identificación y trazabilidad únicas de un dispositivo médico específico. El UDI-DI (Identificación Única de Dispositivo – Device Identifier) es la clave principal para el registro de PRODUCTOS EN EUDAMED.
- Vinculación con el UDI-DI básico principal (Parent Basic UDI DI Code) para la clasificación en una familia de productos.
- Ingreso del número de material (material) y descripción del material (texto del material) para referencia interna.
- Adjudicación de la UDI-DI por un organismo acreditado (Organismo Emisor de la UDI-DI) e introducción del código único (Código UDI-DI).
- Determinación del estado del dispositivo (Device Status)
- Indicación del propósito que no sea médico (MDR Propósito que no sea médico)
- Registro del número de piezas por unidad de venta (cantidad de dispositivo) y la máxima reutilización (máx. número de reutilizaciones).
- Especificación del desarrollador del producto (Product Designer SRN y Product Designer ID).
- Número de referencia único para la identificación en documentos y embalajes.
- Marcado directo en el producto (marcado directo) e información sobre: mismo DI para el marcado directo que para UDI-DI (DM DI igual que el código UDI-DI); agencia emisora para el marcado directo (agencia emisora DM); código de marcado directo (código DM DI)
- Etiquetado estéril (dispositivo etiquetado como estéril) y requisito de esterilización antes de su uso (el dispositivo necesita esterilización antes de su uso)
- Indicación de si se trata de un nuevo producto (nuevo dispositivo) según IVDR
- Contiene látex (Contiene látex)
- Dispositivo de un solo uso reprocesado
- Etiquetado como de un solo uso
- Identificador de producción (PI): número de lote o partida; fecha de caducidad; fecha de fabricación; número de serie e identificación del software
- Identificadores adicionales: Organismo Emisor Secundario (UDI) y Código UDI-DI Secundario (Código UDI-DI) y Código DI de la Unidad de Uso (UDI) y Organismo Emisor asociado (Organismo Emisor de la Unidad de Uso)
- Más información: URL para obtener información adicional (eIFU)
- Información del certificado:
- Ingreso del código UDI-DI Básico asociado (Basic UDI Code) para enlace único al certificado.
- Ingreso del número de certificado (Certificado No.) según el Organismo Notificado (NB) y gestión del número de revisión (Certificado Revisión No. – Cert. rev. no.), por ejemplo, en caso de renovación o cambio.
- Selección del tipo de certificado (Tipo de certificado – Tipo de certificado) de una lista predefinida (por ejemplo, certificado de conformidad de la UE, certificado QMS) y entrada del Código del Organismo Notificado (Código NB – Código del Organismo Notificado), así como la indicación de la fecha de caducidad del certificado si es un producto bajo MDD, IVDD o AIMDD.
- Investigación clínica
- Registro del ID de Investigación Clínica de acuerdo con el protocolo del estudio o la entrada en la base de datos.
- Indicación del país en el que se realizó el ensayo clínico
- Idioma y propósito médico
- Selección del idioma en el que se proporciona la información relacionada con el producto (por ejemplo, etiqueta, instrucciones de uso, datos de EUDAMED).
- Indicación de la finalidad médica
- Información de empaque (jerarquía de empaque):
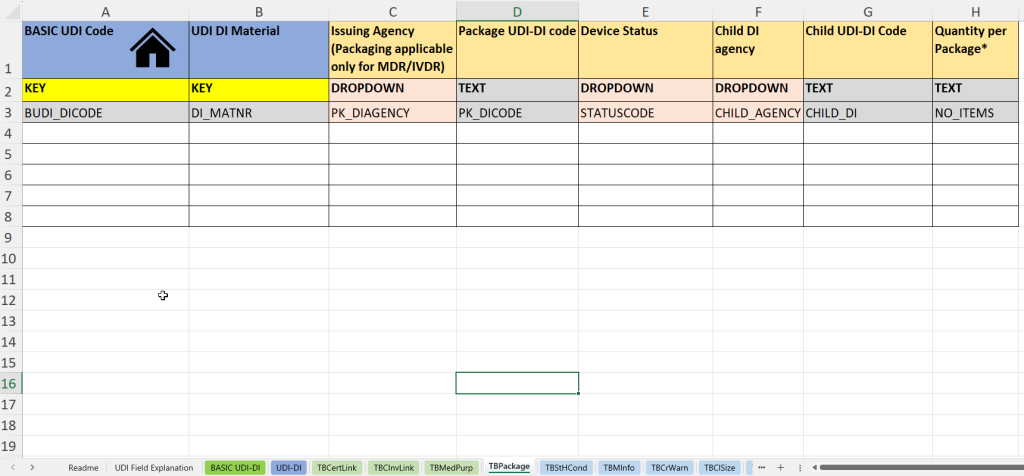 esta pestaña documenta información sobre unidades de empaque, así como sobre estructuras UDI-DI secundarias («UDI secundaria»), particularmente relevante para empaques o conjuntos multinivel.
esta pestaña documenta información sobre unidades de empaque, así como sobre estructuras UDI-DI secundarias («UDI secundaria»), particularmente relevante para empaques o conjuntos multinivel.
- Número de material UDI-DI (material UDI DI) para la identificación interna de la unidad de embalaje.
- Organismo emisor de envases UDI-DI (Organismo emisor – Envases)
- Ingreso del código UDI-DI del empaque (Código UDI-DI del paquete), por ejemplo, para empaques exteriores o kits.
- Estado del producto o embalaje (estado del dispositivo), por ejemplo, activo/inactivo.
- Indicación del organismo emisor de UDI Infantil (Child DI Agency), si se trata de UDI-DI subordinados.
- Código UDI-DI del niño: código UDI del producto del niño dentro de la unidad de embalaje.
- Cantidad por paquete: importante para conjuntos, blísteres o envases múltiples.
- Condiciones de almacenamiento y manipulación:
-
Número de material UDI-DI (material UDI DI) para identificar la unidad en cuestión.
-
Especificación de las condiciones de almacenamiento y manipulación (Tipo de condiciones de almacenamiento y manipulación).
-
Idioma para la descripción y descripción complementaria para una explicación más detallada de los requisitos especiales de almacenamiento o notas.
-
Por favor rellene el formulario para solicitar una cotización
- Información de mercado:
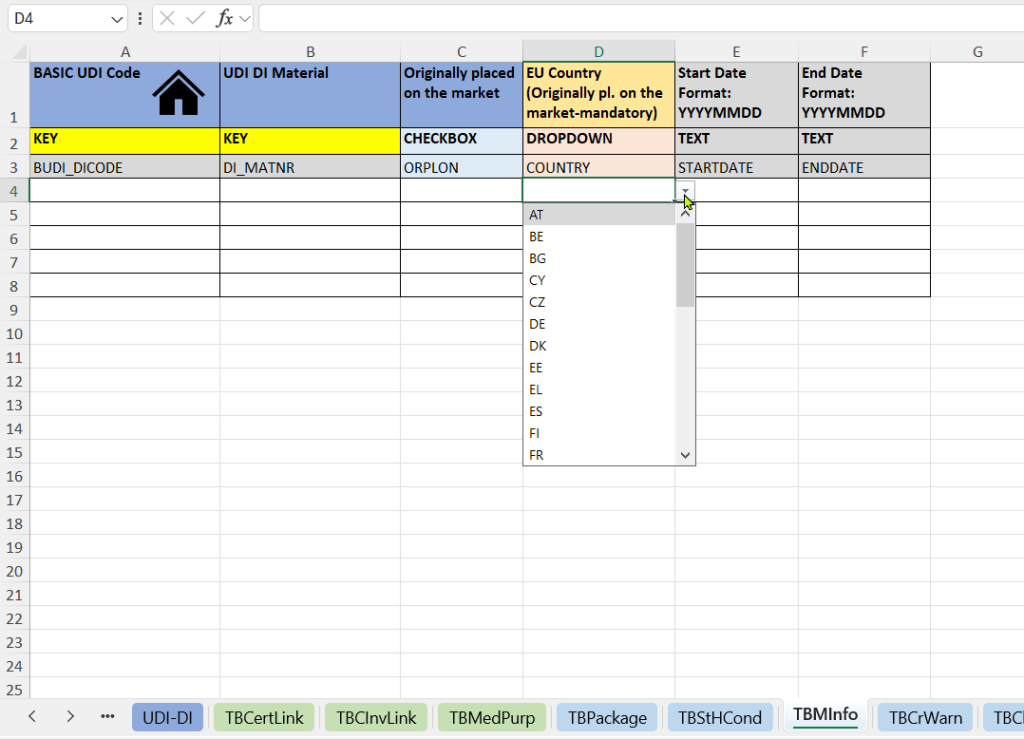 esta pestaña documenta cuándo y dónde se introdujo por primera vez un producto en el mercado. Proporciona evidencia relevante desde el punto de vista regulatorio para productos compatibles con MDR/IVDR y productos heredados.
esta pestaña documenta cuándo y dónde se introdujo por primera vez un producto en el mercado. Proporciona evidencia relevante desde el punto de vista regulatorio para productos compatibles con MDR/IVDR y productos heredados.
- Indicación de si el producto se comercializó originalmente.
- País de la UE: introducido originalmente en el mercado.
- Fecha de lanzamiento al mercado (Fecha de inicio y Fecha de finalización).
- Advertencia crítica
- Selección del tipo de advertencia crítica, por ejemplo, implante, látex, radiactividad, etc.
- Información de tamaño
- Especificación del formato de tamaño (tipo de tamaño), por ejemplo, numérico, alfanumérico, simbólico
- Exactitud/precisión de la especificación de tamaño (precisión)
- Unidad de tamaño
- Valor o valor mínimo (Valor /Valor mín.) y valor máximo (Valor máx.)
- Sustancias Humanas (Pestaña de Sustancias Humanas Médicas)
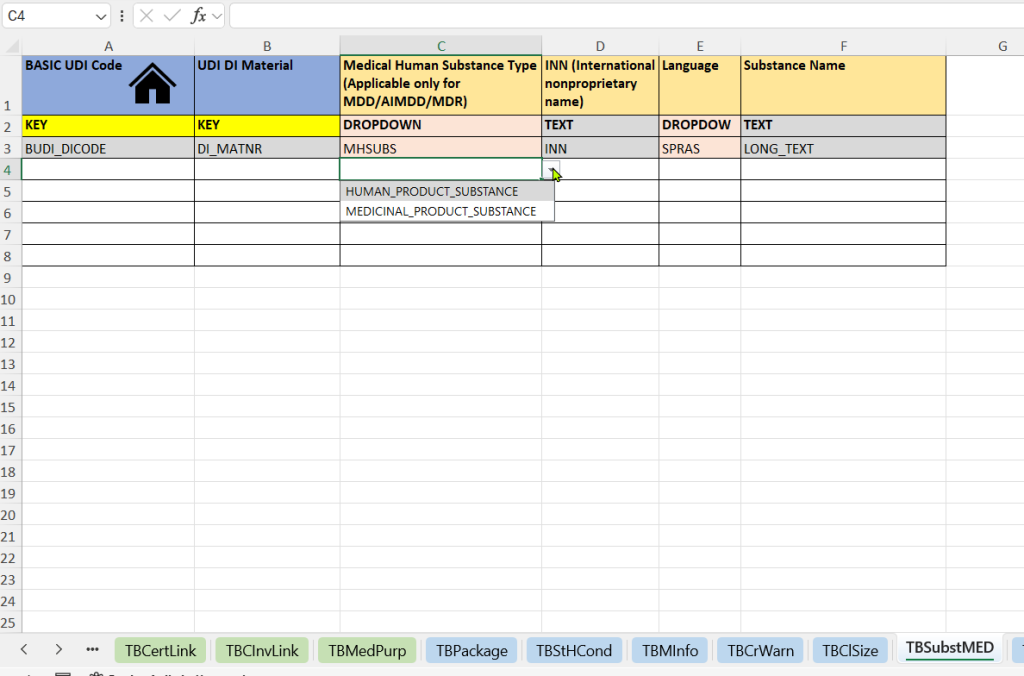
-
Selección del tipo de sustancia (tipo de sustancia médica humana)
-
Registro de la Denominación Común Internacional (DCI)
-
Especificación del idioma: para la representación específica del idioma de la especificación de la sustancia
-
Nombre de texto libre de la sustancia (nombre de la sustancia): descripción adicional o nombre de uso nacional
-
- CMR/Sustancias Endocrinas (CMR Endocrine Substances)
-
Selección del tipo de sustancia (sustancias endocrinas CMR) – por ejemplo, CMR categoría 1A/1B, disruptores endocrinos (campo: CMRENDSUBS).
-
Especificación del código CAS – Chemical Abstracts Service Identifier (campo: CASCODE).
-
Especificación del código CE/EINECS/CE (código CE) – Identificador europeo de sustancias (campo: ECCODE).
-
Idioma: para descripciones localizadas, si es necesario (campo: SPRAS).
-
Nombre de texto libre de la sustancia (nombre de la sustancia) – por ejemplo, nombre comercial o descripción específica (campo: LONG_TEXT).
-
- Descripción adicional del producto
-
Selección del idioma en el que se realizará la descripción adicional (campo: SPRAS).
-
Registro de la descripción adicional del producto
(campo: DESCR – por ejemplo, para explicar la función, composición o característica especial del conjunto)
-
- Pestaña Nombre comercial
-
Selección del idioma para el nombre comercial (campo: SPRAS).
-
Registro de nombre comercial
(obligatorio – Campo: TRD_NAME, por ejemplo, «Stent CardioFlow», «Kit de prueba rápida MediCheck»)
-
- Código de nomenclatura (Nomenclatura EMDN)
- Selección del código EMDN apropiado (Código de Nomenclatura – EMDN) de la base de datos oficial de EUDAMED.
Por favor rellene el formulario para solicitar una cotización
Funciones inteligentes para una máxima eficiencia:
- Resaltado de color de los campos obligatorios:

- Identificación visual inmediata de las entradas obligatorias
- Distinción entre campos obligatorios condicionales y absolutos
- Visualización contextual de campos relevantes en base a entradas anteriores
- Menús desplegables validados:
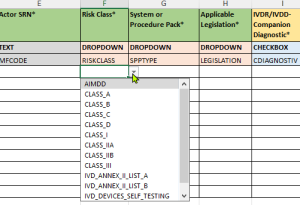
- Opciones predefinidas de acuerdo con los requisitos de EUDAMED
- Listas de valores actualizadas de acuerdo con las últimas especificaciones de la Comisión de la UE
- Reducción de errores de entrada a través de opciones estandarizadas
- Comprobaciones automáticas de dependencia:
- Ajuste dinámico de los campos de entrada en función del tipo de producto y la clasificación
- Comprobación lógica de la coherencia de los datos entre las diferentes pestañas
- Advertencias sobre posibles incoherencias en la entrada de datos
- Apoyo bilingüe:
- Descripciones paralelas en alemán e inglés
- Usabilidad internacional para equipos globales
- Terminología coherente según la documentación oficial de EUDAMED
- Ayudas para ladocumentación:
- Explicaciones integradas de campos complejos
- Notas sobre los requisitos reglamentarios
- Consejos para una entrada de datos óptima
Gama completa de servicios para su conformidad con EUDAMED
- Plantilla Excel EUDAMED MDR/IVDR: la base profesional para su gestión estructurada de datos UDI con todas las funciones descritas anteriormente.
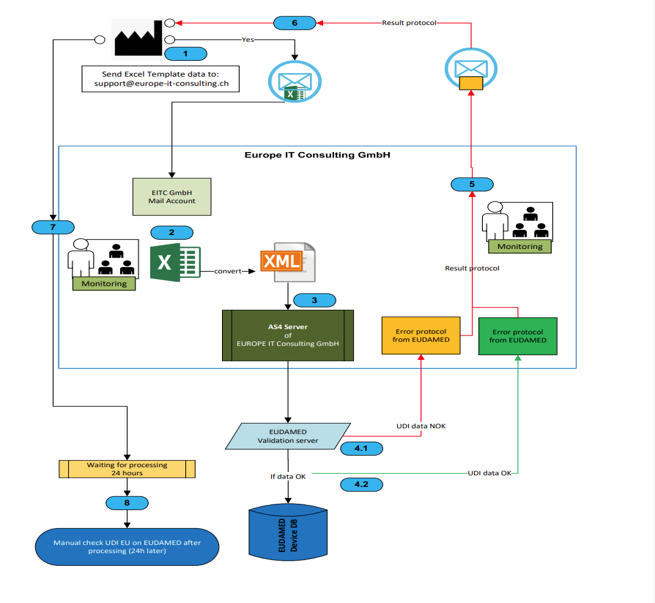
- Servicio de conversión XML: Importante: La conversión de los datos de Excel al formato XML requerido por EUDAMED no se realiza automáticamente dentro de la plantilla. ¡Nuestros expertos se encargan de esta compleja tarea por usted como un servicio separado!
- Servicio de transmisión de EUDAMED: nos encargamos de todo el proceso de transferencia de datos a la base de datos de EUDAMED de forma segura, rápida y fiable.
Especificaciones técnicas de la plantilla de Excel
- Formato de archivo: Microsoft Excel (.xlsx)
- Compatibilidad: Microsoft Excel 2016 y superior
- Tamaño: optimizado para tiempos de carga rápidos, incluso con grandes conjuntos de datos
- Seguridad: estructuras protegidas por contraseña para evitar cambios involuntarios
- Actualizaciones: actualizaciones periódicas de acuerdo con los últimos requisitos de EUDAMED
- Idiomas: alemán e inglés
- Validación de datos: rutinas de verificación integradas para entradas consistentes
Por favor rellene el formulario para solicitar una cotización
Por qué las principales empresas de tecnología médica confían en nuestra solución
Europe IT Consulting GmbH no solo cuenta con la certificación ISO 9001 y es socio de SAP: somos su socio estratégico para la transformación digital de sus procesos regulatorios.
Esto es lo que hace que nuestra plantilla de Excel sea única:
- Estructuración precisa de acuerdo con los requisitos de EUDAMED para los atributos básicos UDI-DI y UDI-DI
- Menús desplegables inteligentes con opciones validadas
- Resaltado visual de campos obligatorios y campos dependientes
- Navegación intuitiva por el complejo mundo de los datos UDI
- Soporte multilingüe para equipos internacionales (DE/EN)
- Preparación óptima para su posterior procesamiento por parte de nuestros expertos
- ANALIZAR: Reconozca el valor de nuestra solución total para sus desafíos específicos. «El primer paso para la optimización del cumplimiento»
- COMPRA: Obtenga fácil acceso a nuestra plantilla de Excel a través de Digistore24. “La piedra angular de tu estrategia regulatoria”
- IMPLEMENTACIÓN: captura los datos de tu producto en la estructura de plantilla fácil de usar. «No más entrada complicada de datos UDI»
- BENEFICIO: encargue la conversión XML y la transferencia EUDAMED, y disfrute de un flujo de trabajo EUDAMED totalmente seguro. «Céntrese en su negocio principal mientras nosotros nos encargamos de la implementación técnica»
Perfectamente adaptada a sus necesidades individuales
Para carteras de productos pequeñas y medianas:
La plantilla de Excel es la base ideal para la recopilación de datos de hasta 20 registros, complementada por nuestro servicio de conversión y transferencia.
Para líneas de productos extensas:
La base perfecta para integraciones M2M con mayores cantidades de datos (más de 20 entradas UDI-DI), con el apoyo adicional de nuestros expertos en TI.
Para los usuarios de SAP:
Maximice sus beneficios a través de una integración perfecta con nuestro complemento SAP EUDAMED de UDI.
Lo que dicen nuestros clientes
“La combinación de la plantilla Excel de Europe IT Consulting y el servicio de conversión ha revolucionado nuestro proceso de envío de EUDAMED. Lo que antes tomaba días, ahora lo hacemos en horas, con una calidad de datos significativamente mayor.» — Fabricante de tecnología médica, Alemania
«La estructura intuitiva de la plantilla de Excel y el soporte profesional en la conversión XML y la transferencia EUDAMED nos dan la seguridad de estar siempre en cumplimiento.» — Gerente de Asuntos Regulatorios, Suiza
«Particularmente valiosos son los menús desplegables predefinidos y el marcado de color de los campos obligatorios. De esta manera, siempre tenemos una visión general de qué datos son absolutamente necesarios.» — Gerente de Calidad, Austria
Preguntas frecuentes para que tu decisión sea más fácil
¿Hay algún coste adicional por las actualizaciones de la plantilla de Excel?No, todas las actualizaciones importantes de la plantilla se incluyen en tu compra sin cargo adicional.
¿Puedo crear archivos XML para EUDAMED yo mismo con la plantilla de Excel?No, la plantilla de Excel se utiliza exclusivamente para la recopilación estructurada de sus datos UDI. Ofrecemos la conversión al complejo formato EUDAMED XML como un servicio independiente, ya que este proceso requiere conocimientos técnicos especiales.
¿Cómo se transfieren mis datos a la base de datos de EUDAMED?Después de recopilar datos en la plantilla de Excel, puede utilizar nuestro servicio de transferencia. Nuestros expertos convierten sus datos en el formato correcto y los transmiten de forma segura a la base de datos EUDAMED.
¿Cómo se realiza la copia de seguridad de mis datos introducidos?La plantilla de Excel tiene funciones integradas para el almacenamiento local de datos. También recomendamos realizar copias de seguridad periódicas de acuerdo con las pautas de seguridad interna de su empresa.
¿Puedo usar la plantilla para varios productos o líneas de productos?Por supuesto. La plantilla está diseñada para gestionar múltiples UDI-DI básicos y numerosos UDI-DI asociados en una estructura clara.
¿Necesito conocimientos especiales de Excel para usar la plantilla?No, la plantilla se desarrolló para usuarios con conocimientos básicos de Excel. La interfaz de usuario intuitiva y la estructura clara facilitan la entrada incluso sin conocimientos previos especiales.
¿Se actualizará la plantilla en caso de cambios normativos?¡Por supuesto! Actualizamos proactivamente todas las listas de valores e integramos nuevos requisitos tan pronto como la Comisión Europea los publica, su garantía de cumplimiento continuo.
Actúe ahora: ¡asegure su ventaja regulatoria!
Se acaba el tiempo y se acercan los plazos de EUDAMED. Elija la solución completa en la que confían hoy las principales empresas de tecnología médica.
Su primer paso para optimizar el cumplimiento de UDI:
Por favor rellene el formulario para solicitar una cotización
¡Invierta en una estrategia regulatoria eficiente ahora!
La plantilla de Excel EUDAMED MDR/IVDR es desarrollada y distribuida por Europe IT Consulting GmbH, su socio certificado para soluciones de TI regulatorias desde 2011.
