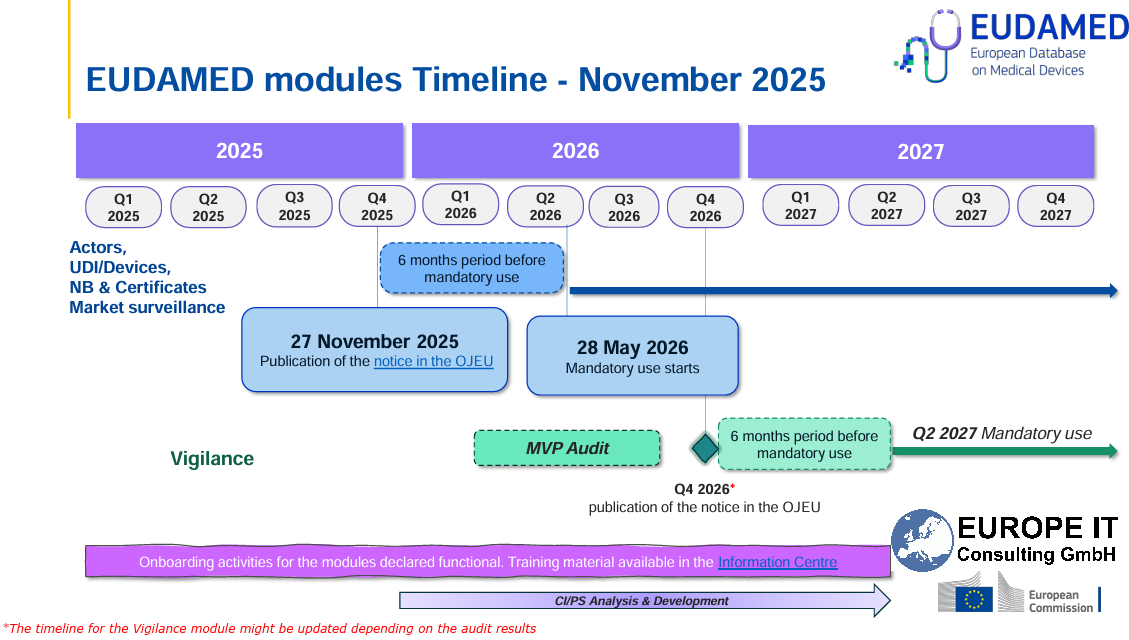
EUDAMED: Cuatro módulos obligatorios a partir del 28 de mayo de 2026
on la publicación de una nueva Decisión de Ejecución en el Diario Oficial de la Unión Europea el 27 de noviembre de 2025, la Comisión Europea ha confirmado oficialmente que los cuatro primeros módulos de EUDAMED son plenamente operativos. Esto activa un periodo transitorio de seis meses.
A partir del 28 de mayo de 2026, el uso de estos módulos será obligatorio.
Los siguientes módulos se ven afectados:
-
Registro de agentes económicos (Actor Registration)
-
Registro UDI / de dispositivos (UDI / Device Registration)
-
Organismos notificados y certificados (Notified Bodies & Certificates)
-
Vigilancia del mercado (Market Surveillance)
Calendario de implantación de EUDAMED

La hoja de ruta actual de EUDAMED (a noviembre de 2025) prevé los siguientes hitos:
-
27 de noviembre de 2025
Publicación en el Diario Oficial de la UE del anuncio que confirma la plena operatividad de los cuatro primeros módulos -
28 de mayo de 2026
Inicio del uso obligatorio de los siguientes módulos:-
Registro de agentes económicos (Actor Registration)
-
Registro UDI / de dispositivos (UDI / Device Registration)
-
Organismos notificados y certificados (Notified Bodies & Certificates)
-
Vigilancia del mercado (Market Surveillance)
-
-
4.º trimestre de 2026 (previsto)
Anuncio separado que confirmará la plena operatividad del módulo de Vigilancia / Post-Market Surveillance -
2.º trimestre de 2027 (previsto)
Uso obligatorio del módulo de Vigilancia
Los dos módulos restantes – Vigilancia y Post-Market Surveillance y Investigaciones clínicas y estudios de rendimiento (Clinical Investigations & Performance Studies) – solo se activarán cuando su uso pase a ser inmediatamente obligatorio. No se prevé una fase voluntaria prolongada para estos módulos.
Plazos de registro según el tipo de dispositivo

Los plazos de registro dependen principalmente de cuándo se comercializa por primera vez un dispositivo en el mercado de la UE. La guía de implantación distingue tres escenarios principales.
1. Nuevos dispositivos MDR/IVDR (“regulation devices”)
Dispositivos que se comercializan por primera vez en el mercado de la UE el 28 de mayo de 2026 o después:
-
Deben estar registrados en el módulo UDI / Device antes de su comercialización en la UE.
-
Sin un registro válido UDI / Device en EUDAMED, estos productos no pueden comercializarse.
2. Dispositivos legacy y dispositivos MDR/IVDR ya existentes
Dispositivos que ya están en el mercado antes del 28 de mayo de 2026, ya sea como:
-
Dispositivos legacy bajo MDD/AIMDD/IVDD, o
-
Dispositivos ya conformes con MDR/IVDR,
se benefician de un periodo transitorio de 12 meses tras la publicación del anuncio en el Diario Oficial.
-
Con el anuncio publicado el 27 de noviembre de 2025, esto significa:
👉 Estos dispositivos deberán estar registrados en el módulo UDI / Device a más tardar el 27 de noviembre de 2026.
3. Dispositivos que ya no se comercializan
Dispositivos legacy o de reglamento que se retiran definitivamente del mercado antes del 28 de mayo de 2026, pero que pueden seguir en la cadena de distribución:
-
No necesitan registrarse en general en el módulo UDI / Device,
-
a menos que se produzca un acontecimiento de vigilancia o PMS que deba notificarse a través de EUDAMED una vez que el módulo de Vigilancia sea de uso obligatorio (previsiblemente a partir del 2.º trimestre de 2027).
¿Qué implica esto en la práctica para los fabricantes?
Para fabricantes, representantes autorizados e importadores, estos hitos se traducen en necesidades de acción concretas en varias áreas.
1. Garantizar el registro de agentes económicos (SRN)
-
Comprobar si todos los agentes económicos relevantes (fabricantes, representantes autorizados, importadores y, en su caso, fabricantes de sistemas y lotes de procedimientos) ya están registrados y validados como Actors en EUDAMED.
-
Sin un registro válido de Actor y un SRN activo, no será posible registrar dispositivos ni presentar notificaciones de vigilancia en el futuro.
2. Estructurar los datos UDI y los datos maestros
-
Preparar los datos UDI y los datos maestros de forma que puedan exportarse y enviarse a EUDAMED con una estructura plenamente conforme, ya sea mediante:
-
Plantillas Excel y cargas masivas
-
Envíos basados en XML
-
Interfaces M2M desde sistemas como SAP o PLM
-
-
Armonizar las fuentes de datos (ERP/SAP, PLM, listas Excel existentes, sistemas de etiquetado, etc.) para evitar retrabajos manuales e incoherencias.
3. Agrupar el portfolio según la categoría de dispositivo
-
Distinguir claramente entre:
-
Nuevos dispositivos MDR/IVDR comercializados a partir del 28 de mayo de 2026 (registro obligatorio antes de la comercialización)
-
Dispositivos MDR/IVDR existentes y dispositivos legacy que se seguirán vendiendo después del 28 de mayo de 2026 (registro obligatorio antes del 27 de noviembre de 2026)
-
Dispositivos que ya no se comercializarán antes del 28 de mayo de 2026 (registro solo relevante en relación con casos de vigilancia/PMS)
-
Esta visión global del portfolio es esencial para priorizar dispositivos, distribuir la carga de trabajo y garantizar que los productos y mercados críticos estén cubiertos en primer lugar.
4. Pasar de “proyecto” a “proceso”
EUDAMED no es un ejercicio de carga única. Se convertirá en un proceso regulatorio continuo, que abarcará:
-
Lanzamiento de nuevos productos
-
Cambios y recertificaciones
-
Actualizaciones de certificados a través del módulo de Organismos Notificados y Certificados
-
Notificación de incidentes de vigilancia y PMS una vez que el módulo de Vigilancia sea de uso obligatorio
Los fabricantes deberían definir flujos de trabajo estables y repetibles con roles y responsabilidades claros entre Asuntos Regulatorios, Calidad, IT y, en su caso, filiales locales.
Cómo puede ayudarle Europe IT Consulting
Europe IT Consulting apoya a los fabricantes de productos sanitarios para aprovechar de forma eficiente el periodo transitorio hasta mayo de 2026, desde la primera evaluación hasta la implantación de envíos automatizados.
-
Evaluación de preparación para EUDAMED (EUDAMED Readiness Check)
Análisis breve y estructurado del estado de los SRN, de los datos UDI/maestros, del entorno de sistemas (por ejemplo, SAP, Excel, PLM) y de la estrategia global para EUDAMED (basada en Excel, add-on SAP, M2M, portal en la nube). -
Diseño de datos y procesos para UDI y EUDAMED
Diseño de modelos de datos UDI, definición de campos obligatorios y opcionales por autoridad y configuración de un proceso de registro escalable. -
Implantación técnica
Integración de SAP y otros sistemas fuente con EUDAMED – por ejemplo, mediante nuestro marco Global UDI y add-ons, o mediante un Global Submission Portal central para la conversión de Excel a XML y envíos a múltiples autoridades. -
Formación y gestión del cambio
Formación práctica para equipos de Asuntos Regulatorios, Gestión de Calidad e IT sobre estructuras UDI, flujos de trabajo en EUDAMED y modelos de roles.




Related Posts