
Dominar el registro UDI en EUDAMED: ¿por dónde empezar y cómo superar las incertidumbres?
El registro de productos sanitarios en la base de datos europea EUDAMED parece para muchos fabricantes un proyecto titánico: nuevas funciones, nueva lógica de datos (Basic UDI-DI/UDI-DI), altos requisitos de calidad de datos y el temor a cometer errores. Precisamente por eso merece la pena un enfoque sistemático: primero establecer bien las bases, luego aprender con un producto piloto y, finalmente, escalar.
Un punto de referencia clave para la planificación: el uso de los cuatro primeros módulos de EUDAMED será obligatorio a partir del 28 de mayo de 2026 (incluyendo el registro de agentes económicos, UDI/productos, organismos notificados y certificados, y vigilancia del mercado). https://health.ec.europa.eu/latest-updates/eudamed-four-first-modules-will-be-mandatory-use-28-may-2026-2025-11-27_en?
Por dónde empezar: preparación, acceso y SRN
La mejor manera de empezar no es simplemente «teclear» datos, sino crear una base sólida:
-
Asegurar el Actor Registration y el SRN: El Número de Registro Único (SRN) es la clave para casi todos los procesos posteriores. Sin él, sus flujos de trabajo se detendrán.
-
Aclarar el modelo de roles: ¿Quién es el «Local Actor Administrator»? ¿Quién está autorizado para validar los datos? Un concepto de roles claro evita cuellos de botella en la publicación.
-
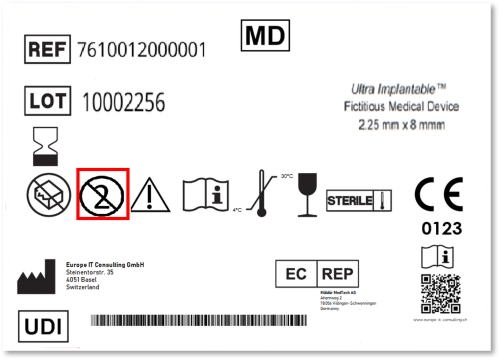
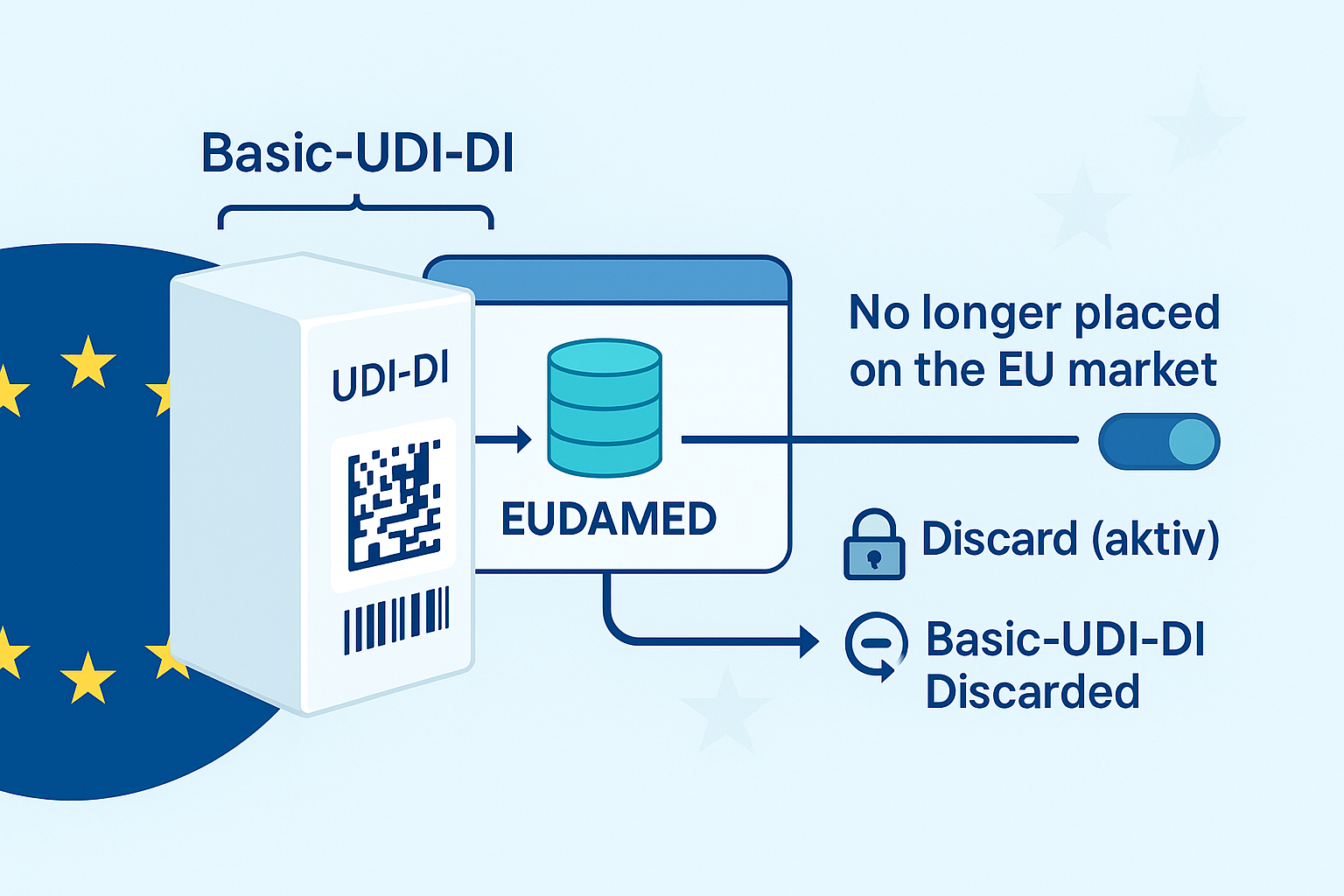
Entender la jerarquía UDI: Antes de recopilar datos, debe haber un consenso interno sobre la estructura.
| Nivel | Función | Ejemplo |
| Basic UDI-DI | Clave de grupo (familia de modelos) | Una familia de catéteres cardíacos |
| UDI-DI | Variante específica / embalaje | Catéter tamaño 5Fr, envase estéril |
| UDI-PI | Datos dinámicos (producción) | Lote, número de serie, fecha de caducidad |
Aclarar los fundamentos esenciales:
-
Clasificación de sus productos según el MDR/IVDR: MDR (UE) 2017/745 e IVDR (UE) 2017/746.
-
Selección de una entidad emisora de UDI designada por la UE: Entidades emisoras (GS1, HIBCC, ICCBBA, IFA).
-
Estructuración de su jerarquía de productos: Basic UDI-DI (clave de grupo), UDI-DI (variante concreta/nivel de embalaje) y UDI-PI (identificador de producción).
Las 3 incertidumbres más comunes y sus soluciones
1. ¿Qué datos son realmente necesarios?
El registro en EUDAMED requiere información estructurada del producto (incluyendo descripción, clasificación, finalidad prevista, lógica de variantes, detalles de embalaje/configuración). En la práctica, los fallos rara vez se deben a la «falta de conocimiento», sino a la falta de sistemática.
Cómo solucionarlo:
-
Cree una lista de verificación interna (el MDR/IVDR sirve de referencia, especialmente el Anexo VI; ver MDR/IVDR arriba). Para ello, lea los documentos de la UE Documento 32017R0745 y Documento 32017R0746.
-
Defina un Conjunto de Datos Mínimo (MVP) para empezar: ¿qué campos deben estar totalmente completos para un producto piloto?
-
Establezca para cada campo de datos cuál es la «Fuente Única de Verdad» (ERP/PLM, etiquetado, documentación técnica, datos maestros de RA).
2. ¿Cuándo se debe realizar el registro (y qué es lo más urgente)?
A menudo se confunden conceptos: el marcado/implementación del UDI (etiqueta/soporte) depende en parte de la clase de riesgo y del producto, pero para el uso de los módulos de EUDAMED hay hitos claros. Por lo tanto, para la planificación del proyecto lo más importante es:
- Establecer la preparación para EUDAMED (roles, SRN, procesos, calidad de datos) con antelación.
- No esperar a que «todo sea perfecto»; en su lugar, realizar pilotos, aprender y escalar.
Para la clasificación de los módulos y la fecha límite: EUDAMED Overview y el anuncio oficial sobre la obligatoriedad a partir del 28.05.2026: Primeros cuatro módulos obligatorios desde el 28 de mayo de 2026
3. ¿Cómo gestiono las variantes de producto?
La lógica de variantes es uno de los mayores obstáculos. Principio básico:
- Basic UDI-DI: Clave de grupo (típica para dispositivos con la misma finalidad/diseño).
- UDI-DI: Identifica variantes concretas o niveles de embalaje.
Cómo hacerlo manejable:
-
Defina internamente qué diferencias activan un nuevo UDI-DI (p. ej., cambios clínicos/técnicos relevantes, nueva configuración, nuevo nivel de embalaje).
-
Documente estas reglas como una «Política de Variantes» para que las decisiones sean repetibles y resistentes a auditorías.
Consejos prácticos para un proceso sin contratiempos
- Asegurar la calidad de los datos (antes de subirlos)
La fuente de error más común son los datos inconsistentes, incompletos o contradictorios. Establezca validaciones internas (campos obligatorios, listas de códigos, valores permitidos) antes de subir datos de forma masiva. - Planificar la integración de TI
Muchos fabricantes reducen significativamente el esfuerzo y la tasa de errores cuando los datos de PLM/ERP se mapean y prevalidan de forma estructurada, especialmente con muchos SKUs/variantes. - Configuración del equipo y formación
UDI/EUDAMED es interdisciplinar: RA/QM, gestión de producto, etiquetado, TI. Asegúrese de que haya una comprensión común de los términos (Basic UDI-DI vs. UDI-DI vs. UDI-PI) y rutas de aprobación claras. - Utilizar el entorno de pruebas de forma sistemática (Playground)
Utilice el Playground para probar roles, procesos y flujos de datos. Importante: El Playground contiene datos válidos, pero ficticios (incluyendo Actor ID/SRN) y no se transfieren al entorno de producción. Explicación oficial: EUDAMED environments y Primeros pasos (nota sobre datos ficticios).
Para el registro de datos concreto en el módulo UDI/Devices, estas páginas oficiales son de ayuda:
No olvide el mantenimiento continuo
El registro inicial es solo el principio. Los cambios en los productos, las nuevas variantes, las actualizaciones de etiquetas o los cambios organizativos deben reflejarse correctamente en EUDAMED. Por lo tanto, defina:
-
Responsabilidades para el mantenimiento continuo (propietario, sustituto).
-
Proceso de cambio (cuándo/quién revisa, quién publica).
-
Revisiones periódicas de datos (calidad, consistencia, integridad).
El registro UDI en EUDAMED no es un «tema de formularios», sino un proyecto de datos y procesos. Si comienza limpiamente con el SRN/roles, aprende con un producto piloto y luego realiza el despliegue por oleadas, la incertidumbre se convertirá en un lanzamiento controlado, eficiente y a prueba de auditorías.
¿Nos vemos en Tuttlingen?
¿Tiene preguntas detalladas sobre su estrategia UDI o tiene dificultades con la validación de datos? Visite a Europe IT Consulting en la regularia 2026 el 3 de marzo (Stand 12).






Related Posts