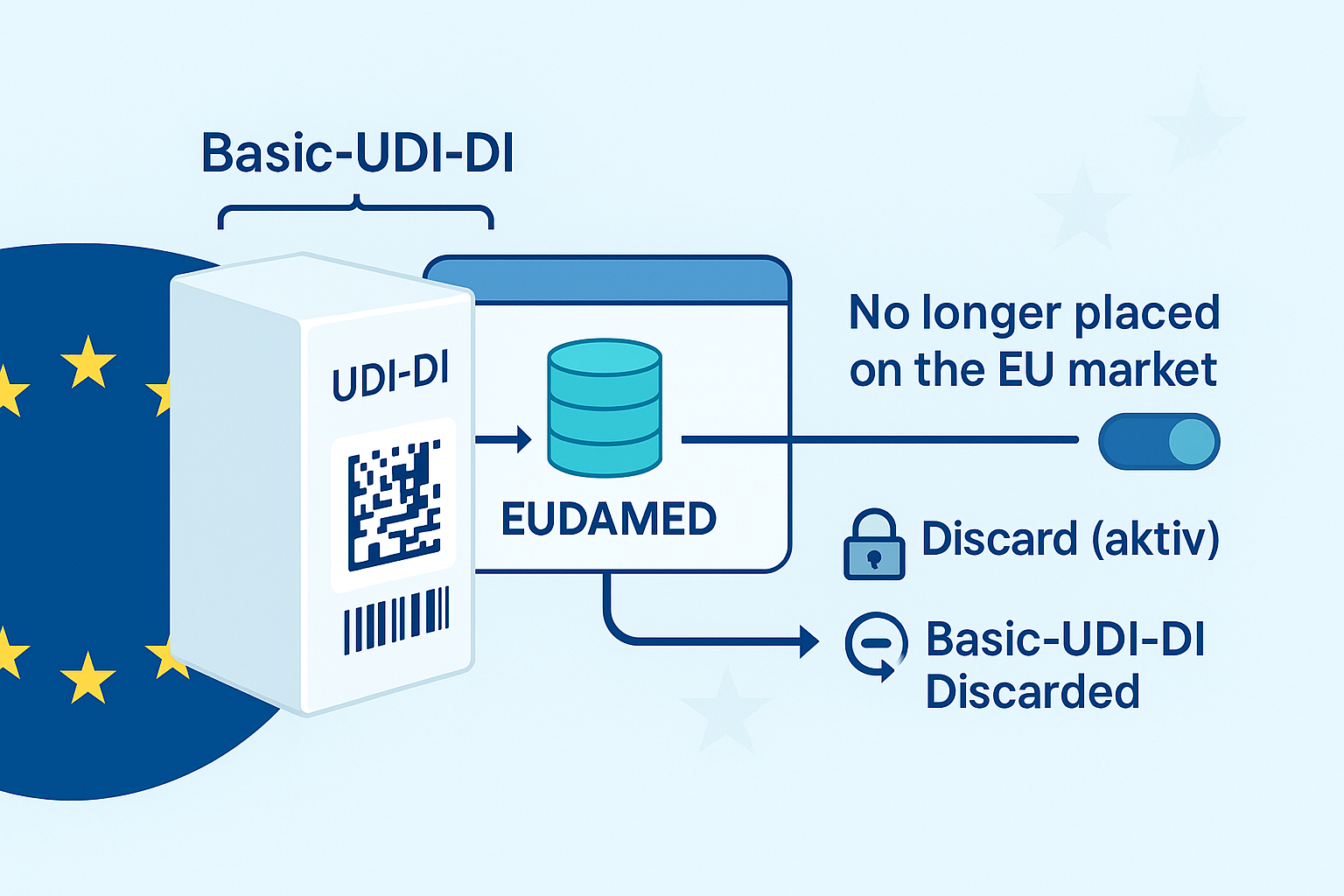
UDI-DI básico en escenarios de transición: ¿Puede un BUDI estar “vacío”?
1. ¿Puede existir un UDI-DI básico (transitorio) sin UDI-DI(s) asociado (s)?
No , en EUDAMED, un UDI-DI básico no se registra de forma aislada. Al registrar Dispositivos de Regulación , la guía de usuario oficial de EUDAMED requiere que siempre se envíe un UDI-DI Básico junto con al menos un UDI-DI ("… no se puede registrar un UDI Básico sin un UDI-DI"). Comisión Europea – Guía del usuario de dispositivos UDI
2. ¿Qué sucede con el UDI-DI básico si el último UDI-DI asociado se establece en "Ya no se comercializa en la UE"?
El cambio de estado no elimina ni el UDI-DI ni el UDI-DI básico. Según la guía del usuario, el estado "Ya no está en el mercado de la UE" oculta la información del mercado; los paquetes de contenedores vinculados se establecen automáticamente en el mismo estado. La eliminación no es automática, sino solo por "Descartar" (acción consciente). Comisión Europea – Guía del usuario de dispositivos UDI
Sin embargo, si "descarta" activamente el último UDI-DI, de acuerdo con las reglas comerciales oficiales: entonces el UDI-DI básico asociado también se establece en "Descartado" (eliminación lógica); Las entradas "Descartadas" ya no son visibles públicamente y los códigos se pueden reutilizar. Además, “Descartar” se bloquea si, por ejemplo, se hace referencia al UDI-DI Básico en certificados o el dispositivo se produce en mensajes de vigilancia. Normas empresariales de la Comisión Europea
3. ¿Qué pasa si el producto no estaba registrado en EUDAMED en absoluto, pero ya existe un BUDI internamente?
-
En el lado de EUDAMED, no existe ningún registro de datos, ya que no se puede registrar un UDI-DI básico sin UDI-DI (ver 1).
-
Legal (MDR): Antes de la comercialización, el fabricante debe presentar el UDI-DI básico, incluidos los datos básicos, a la base de datos UDI; el UDI-DI básico es la clave maestra en la base de datos UDI y se menciona en los certificados y en la declaración UE de conformidad (Anexo VI/IV). EUR-Lex+1
-
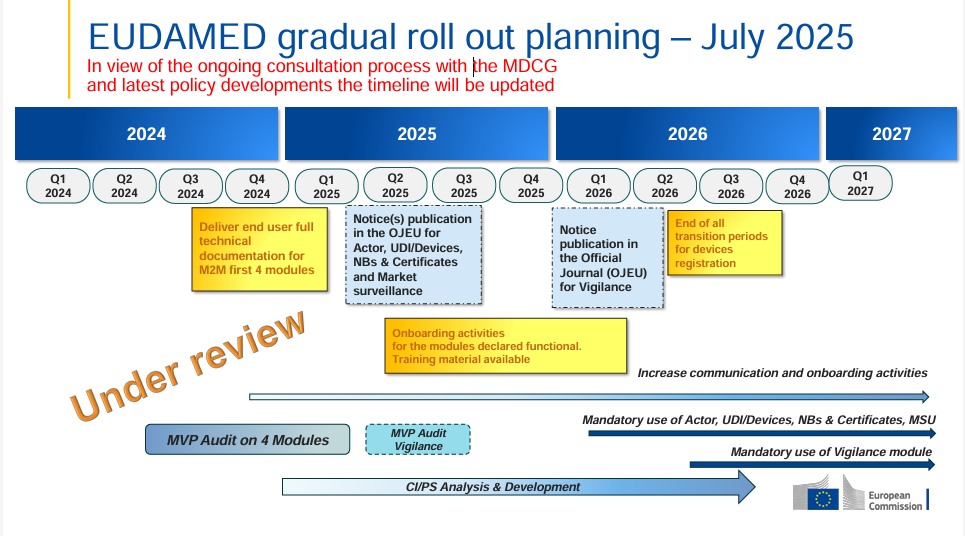
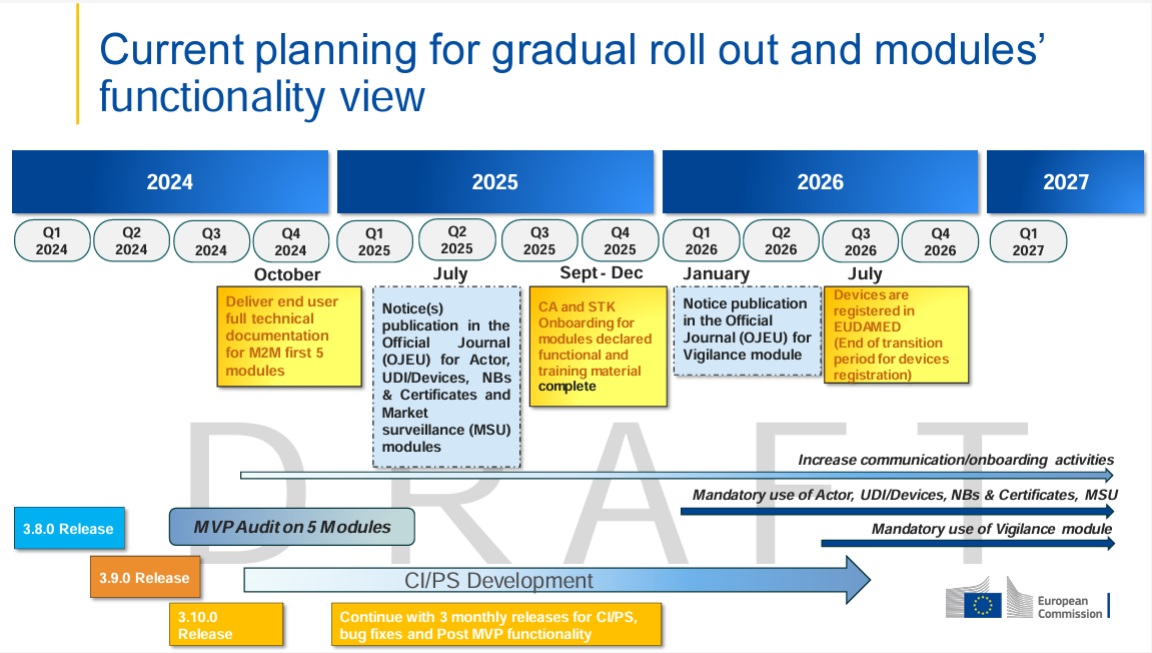
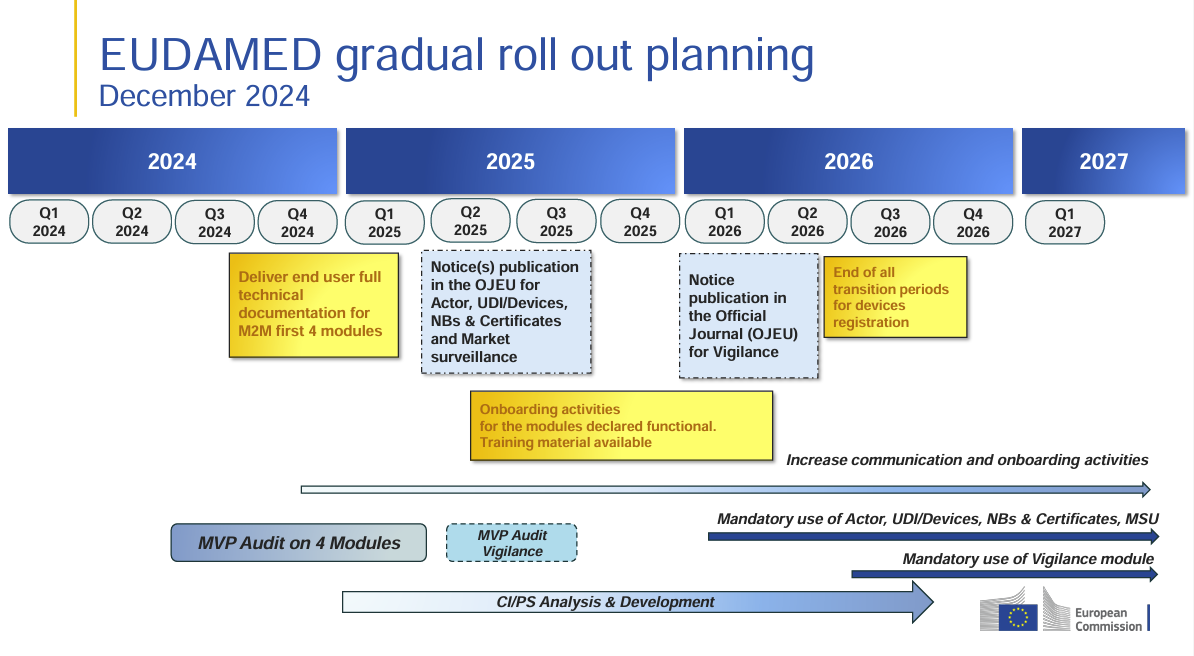
Sobre la obligación actual de usar EUDAMED: El uso del módulo UDI/dispositivo actualmente (a partir de hoy) aún no es vinculante según la Comisión de la UE; las entradas son voluntarias hasta que los módulos respectivos se vuelvan obligatorios mediante notificación en el diario oficial (implementación fase por fase; nueva situación legal 2024/1860). Son posibles obligaciones adicionales nacionales.






Related Posts