
El Reglamento Europeo de Productos Sanitarios (MDR) y los Dispositivos de Un Solo Uso Reprocesados
El Reglamento de Productos Sanitarios de la UE (MDR) ha introducido normas más estrictas y responsabilidades más claras para todos los actores involucrados en el ciclo de vida de los productos sanitarios.
Uno de los temas que genera más preguntas es el reprocesamiento de dispositivos de un solo uso (SUDs) – una práctica que, aunque en apariencia contradictoria, está permitida bajo condiciones específicas.
❓ ¿Qué es un Dispositivo de Un Solo Uso Reprocesado?
Un dispositivo de un solo uso (SUD) está diseñado por el fabricante para ser utilizado una sola vez, en un solo paciente, y durante un único procedimiento.
Según el MDR, estos productos pueden reprocesarse y reutilizarse únicamente si las leyes nacionales lo permiten y se cumplen requisitos estrictos.
La responsabilidad del reprocesamiento recae sobre el fabricante original o sobre un reprocesador autorizado, quien debe cumplir con todas las obligaciones del MDR, tales como la evaluación clínica, el sistema de gestión de calidad y la implementación del UDI.
📝 Cómo declarar un SUD reprocesado en EUDAMED
Al registrar un dispositivo de un solo uso reprocesado en EUDAMED, es obligatorio completar correctamente los siguientes campos:
| Campo de EUDAMED | Valor típico |
|---|---|
| Etiquetado como dispositivo de un solo uso | SÍ |
| Dispositivo de un solo uso reprocesado | SÍ |
| Reutilizable | NO |
| El dispositivo ha sido reprocesado | SÍ |
| Tiene número de serie | Opcional |
Esto garantiza la trazabilidad y el cumplimiento dentro de la base de datos UDI.
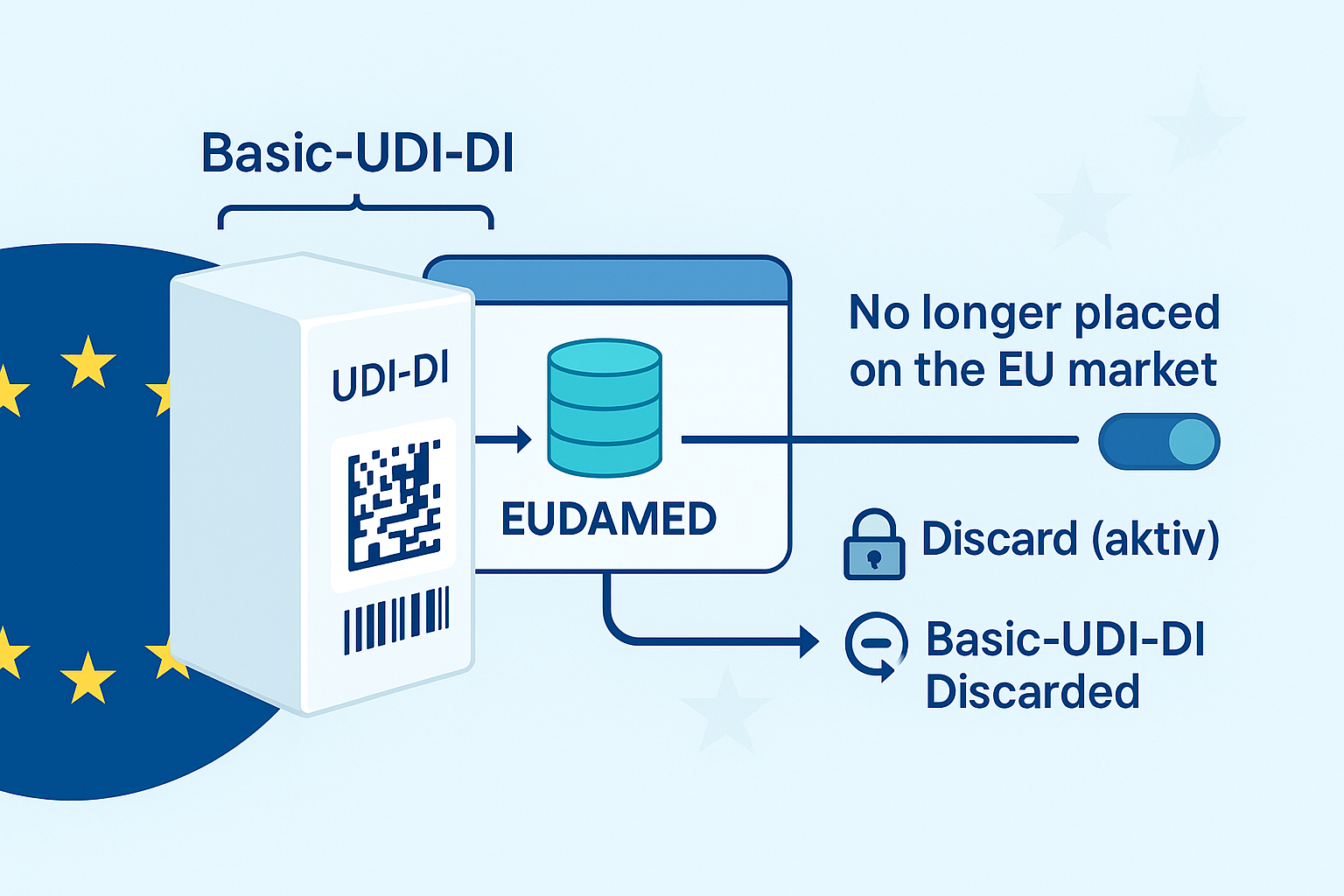
🔁 ¿Cuándo se requiere un nuevo UDI-DI?
Según el Anexo VI, Parte C, Sección 3.9 del MDR, se requiere un nuevo UDI-DI si se da alguno de los siguientes casos:
- El producto ahora está etiquetado como reprocesado
- El producto ha sido reempaquetado y esterilizado
- Ahora se requiere esterilización antes del uso
👉 Aunque el dispositivo físico no haya cambiado, los cambios en el etiquetado, empaquetado o esterilización pueden desencadenar la necesidad de asignar un nuevo UDI-DI.
🏥 Excepción: Reprocesamiento dentro de instituciones sanitarias
Según el Artículo 17(3) del MDR, los Estados miembros de la UE pueden permitir excepciones para hospitales y centros sanitarios:
- Si una institución sanitaria reprocesa un dispositivo de un solo uso para uso interno, puede estar exenta de ciertas obligaciones del fabricante, incluyendo los requisitos de UDI.
- Esta exención solo se aplica si el dispositivo no se comercializa y se utiliza únicamente dentro de la institución.
⚠️ Esta exención no se aplica a reprocesadores comerciales ni a dispositivos destinados a ser distribuidos fuera de la institución.








Related Posts