El ciclo de vida completo de UDI
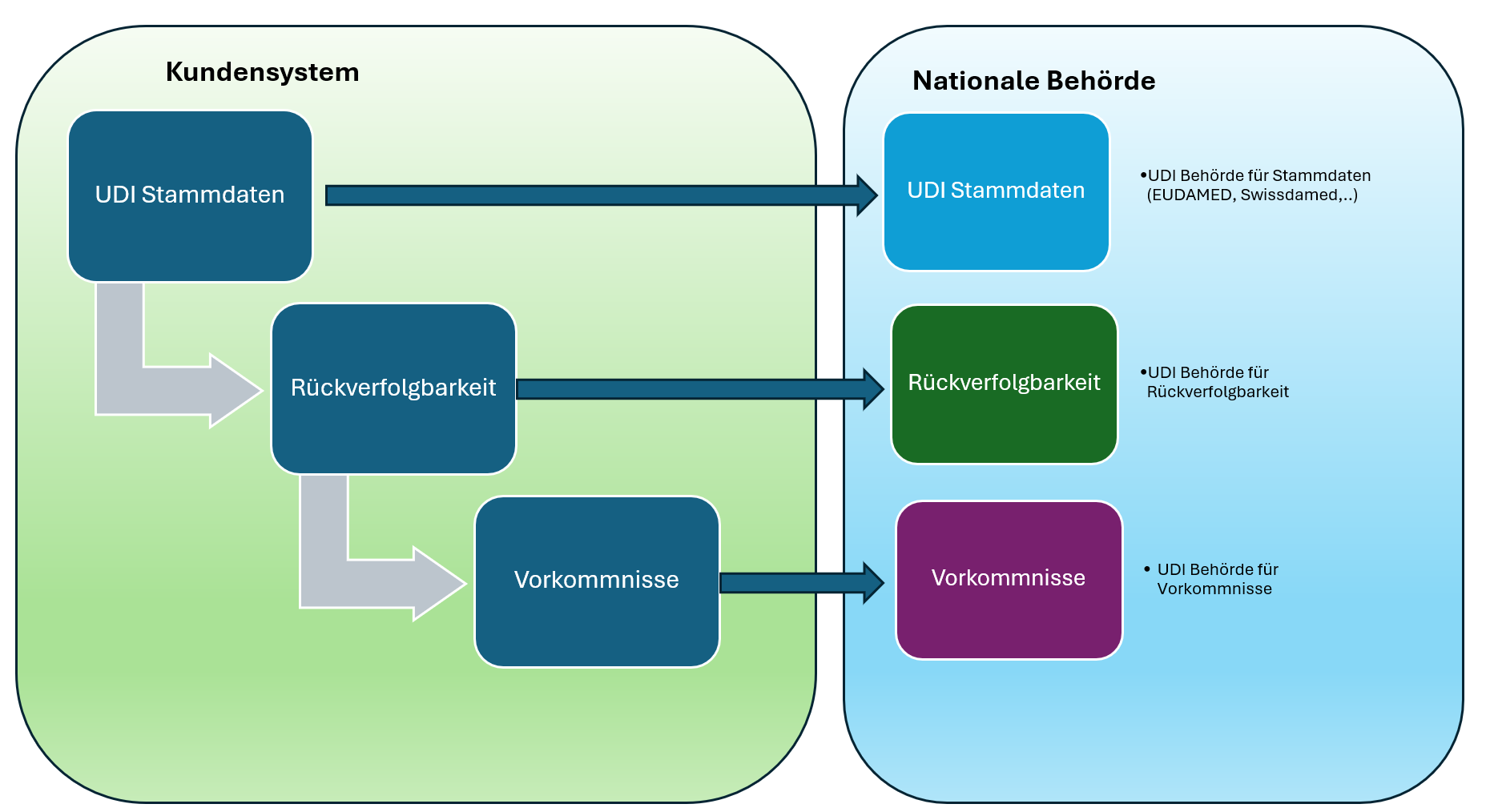
El ciclo de vida completo de UDI: todo de un único proveedor El camino hacia el pleno cumplimiento UDI puede entenderse como un ciclo de datos: Datos maestros UDI →…

El ciclo de vida completo de UDI: todo de un único proveedor El camino hacia el pleno cumplimiento UDI puede entenderse como un ciclo de datos: Datos maestros UDI →…

¿Cuándo es necesario cambiar el estado de UDI-DI?En EUDAMED, el estado (no los datos finales del país) decide si un dispositivo se considera "En el mercado de la UE" o…
¿Deben registrarse en EUDAMED productos hechos a medida (Custom-made devices /CMD)? ¿Y qué pasa con los casos de vigilancia? ¿Qué son los productos hechos a medida según MDR? Por favor,…
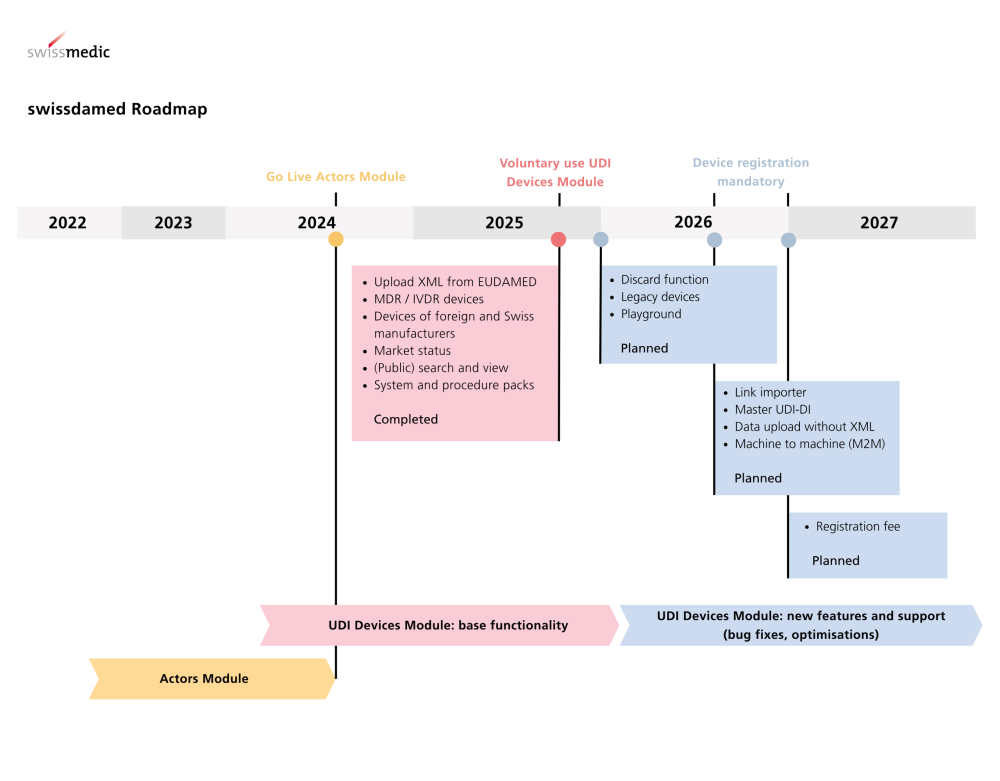
Módulo de dispositivos UDI en directo Swissmedic amplía la base de datos nacional de productos sanitarios con una funcionalidad centralizada. El módulo de dispositivos UDI en swissdamed está en vivo…

Europe IT Consulting renovó con éxito su certificación ISO 9001:2015 El 6 de agosto de 2025, Europe IT Consulting GmbH se sometió a la auditoría de seguimiento realizada por QS…
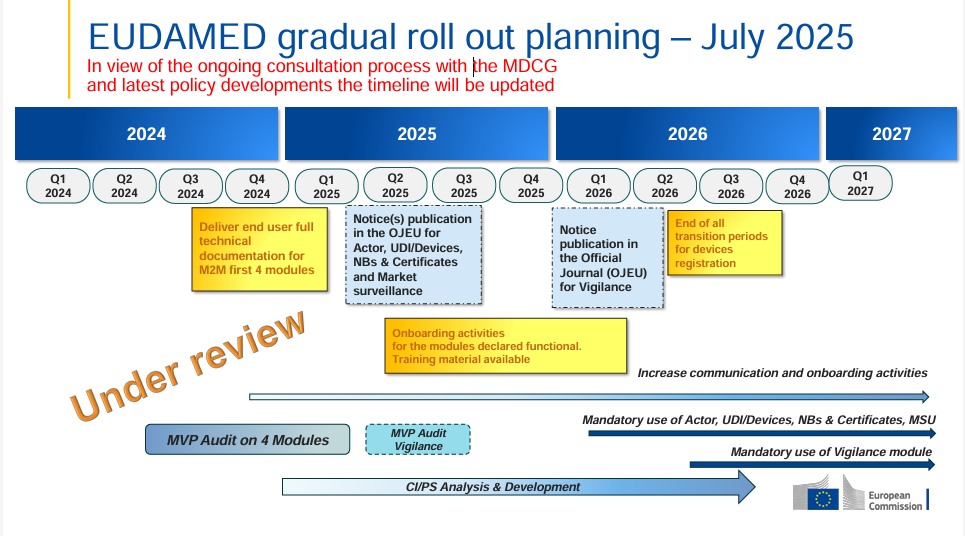
La Comisión Europea ha publicado un plan de implementación actualizado de EUDAMED (julio de 2025), esta vez con una nota clara: el cronograma está ahora “en revisión”. Esto indica que,…
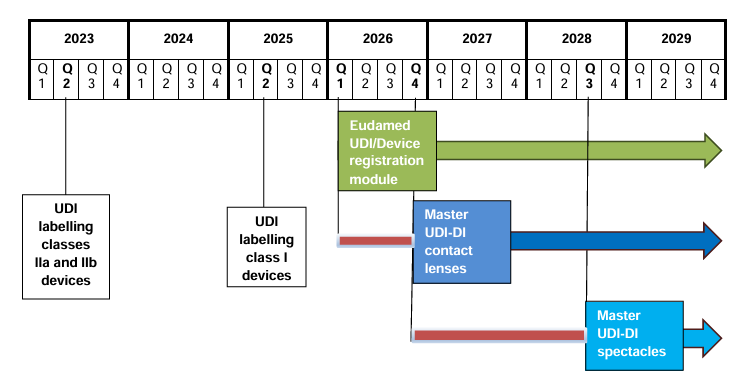
La MDCG publica el calendario para la introducción del Master UDI-DI en gafas y lentes de contacto El Medical Device Coordination Group (MDCG) ha publicado su documento de posición MDCG…

Resumen ejecutivo Turquía se está convirtiendo en un importante mercado de ventas de dispositivos médicos con una población de 85 millones de habitantes y una economía sanitaria en crecimiento. A…

¿Qué es eMDR? eMDR (Electronic Medical Device Reporting) es el sistema de notificación electrónica de la FDA estadounidense para casos de vigilancia relacionados con dispositivos médicos. Este sistema permite la…

Nuevos horarios para la identificación única de dispositivos (UDI) en Australia La Administración Australiana de Bienes Terapéuticos (TGA) ha anunciado los calendarios obligatorios para la introducción de los requisitos de…