
🎥 ¡El seminario web en directo ya ha finalizado, pero aún puedes registrarte para recibir la grabación y los materiales de presentación!
La base de datos EUDAMED desempeña un papel central en el cumplimiento de los reglamentos MDR e IVDR.
Pero, ¿qué significa esto para fabricantes, importadores y distribuidores de productos sanitarios?
¿Cuáles son los plazos clave y cómo se puede enviar la información de forma eficiente y conforme a la normativa?
En nuestro seminario web gratuito con expertos, te ofrecemos una visión completa de las últimas novedades sobre EUDAMED y te mostramos cómo prepararte de la mejor manera para los requisitos que se aproximan.
🔍 ¿Qué puedes esperar?
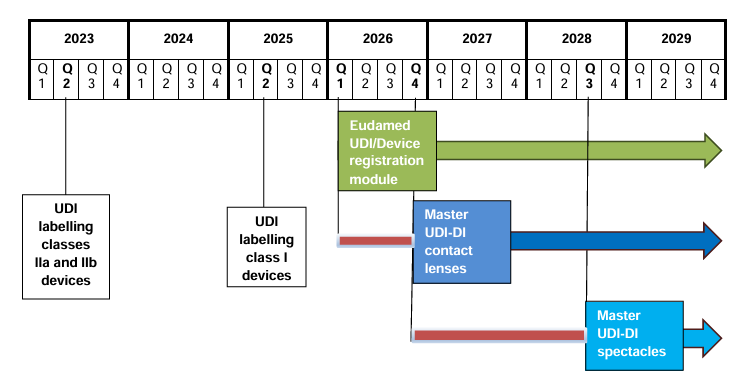
✅ Estado y cronograma – ¿Qué módulos de EUDAMED ya están activos? ¿Qué plazos deben cumplirse?
✅ Códigos EMDN, SRN y terminología – Explicación clara de conceptos clave y requisitos regulatorios
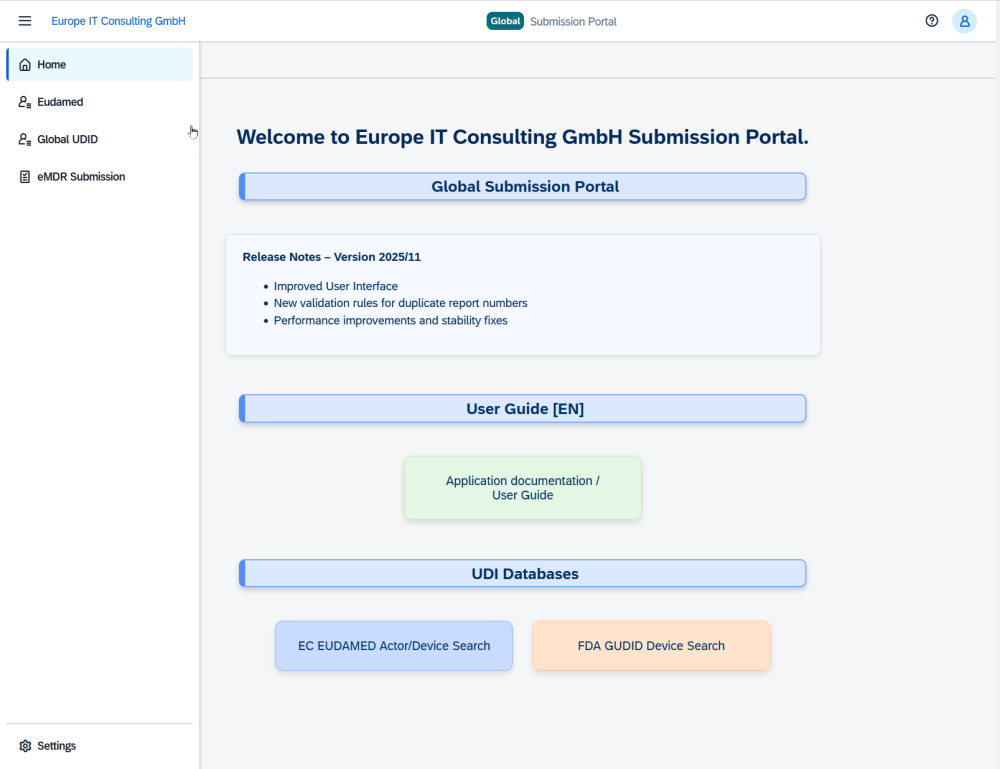
✅ Cómo utilizar el portal de EUDAMED – Guía práctica para navegar por la plataforma
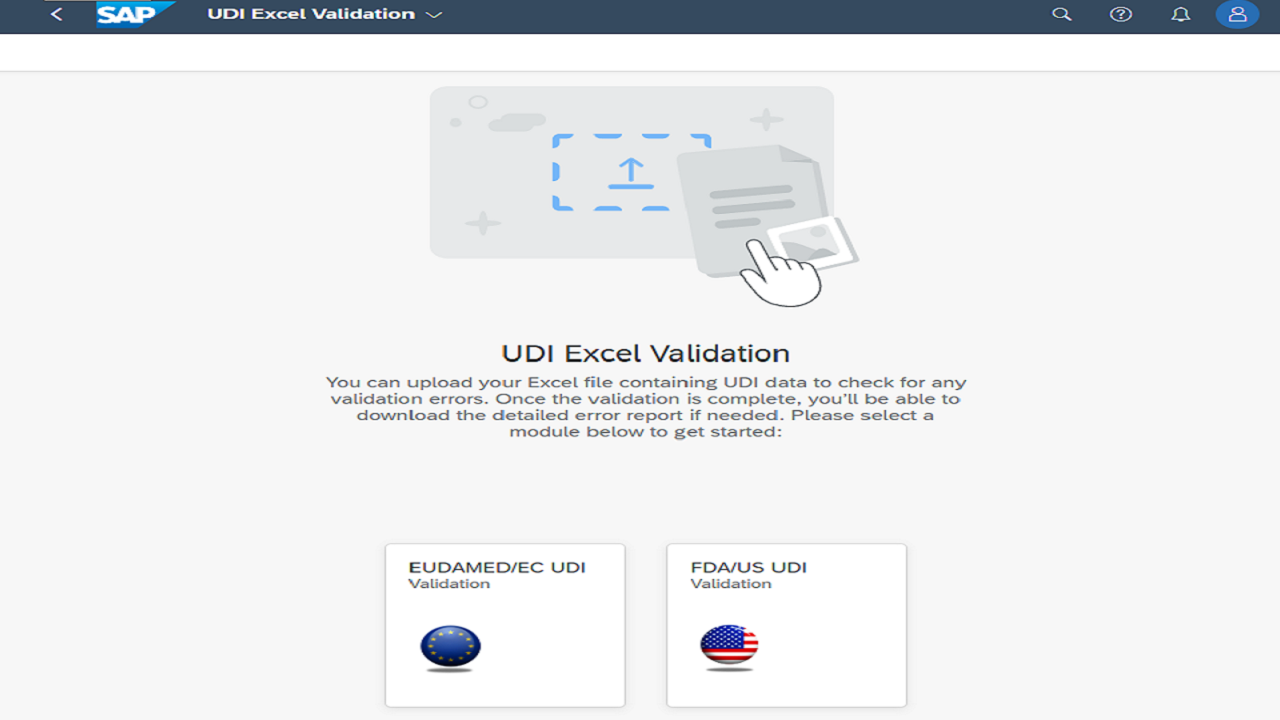
✅ Envío de datos a EUDAMED – Opciones para cargar datos de forma eficiente y segura
🎯 Tus beneficios
🔹 Conocimiento experto de forma clara y práctica
🔹 Información valiosa para una planificación estratégica del cumplimiento normativo
🔹 Sesión de preguntas y respuestas en directo con nuestros expertos en EUDAMED (disponible en la grabación)
🚀 ¡Aunque el seminario web en vivo ya ha terminado, te invitamos a registrarte para recibir la grabación y todos los materiales!







Related Posts