
Nuevos horarios para la identificación única de dispositivos (UDI) en Australia
La Administración Australiana de Bienes Terapéuticos (TGA) ha anunciado los calendarios obligatorios para la introducción de los requisitos de UDI. El sistema UDI forma parte de la estrategia australiana para fortalecer la seguridad del paciente y se adhiere al enfoque globalmente armonizado para la identificación precisa de dispositivos médicos.
Antecedentes y significado
La introducción del sistema australiano UDI permitirá una mejor trazabilidad de los dispositivos médicos. Esto ayuda, en particular:
- Supervisión posterioral mercado: gestión más eficiente de alertas de seguridad y retiros
- Seguridad del paciente: mejora de la identificación en implantes y dispositivos críticos
- Eficiencia regulatoria: armonización con las normas internacionales
- Calidad de los datos: datos de dispositivos uniformes y fiables en AusUDID (Australian Unique Device Identification Database)
La implementación está orientada al riesgo durante 5 años, comenzando con productos médicos de alto riesgo, para proporcionar a los fabricantes y patrocinadores suficiente tiempo de preparación.
Calendarios de cumplimiento para dispositivos médicos
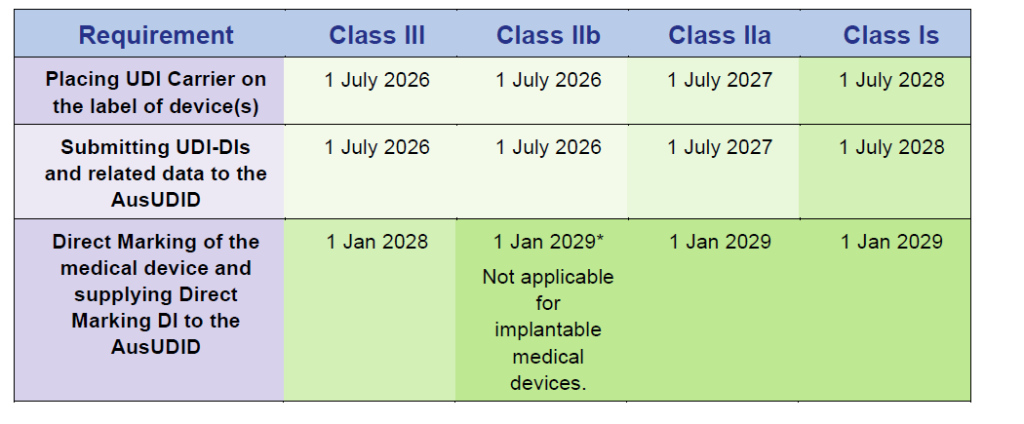
Fuente: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
Calendarios de cumplimiento para productos de diagnóstico in vitro (IVD)
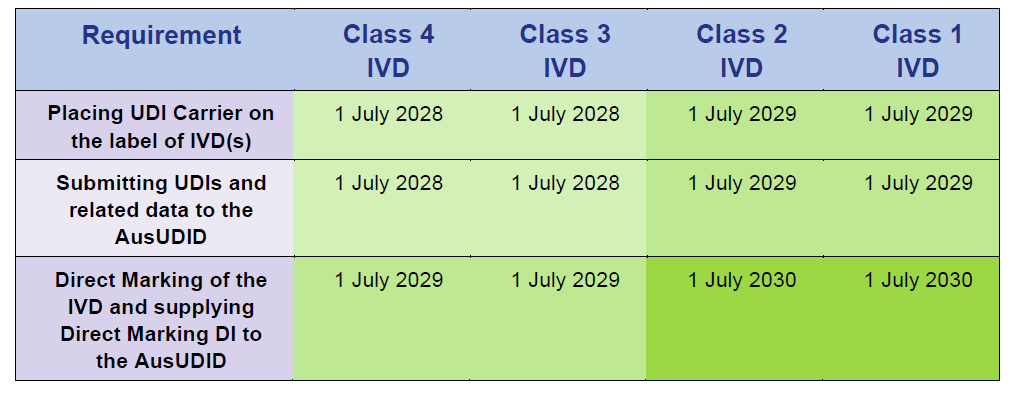
Fuente: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
Requisitos de cumplimiento en detalle
El sistema UDI australiano comprende dos fases principales de cumplimiento:
Fase 1: Identificación y transmisión de datos
- Colocación del soporte UDI en las etiquetas de los dispositivos y en los niveles de embalaje relevantes
- Transmisión del UDI-DI (Device Identifier) y los datos correspondientes al AusUDID
- Vinculación del ID de ARTG con los registros de datos UDI
- Inclusión del UDI en las tarjetas de implantes de pacientes (en el caso de dispositivos implantables)
- Integración del UDI en los mensajes TGA (eventos adversos, incidencias, medidas de mercado)
Fase 2: Marcado directo (si procede)
- Marcado directo de dispositivos reutilizables
- Transmisión de la información de marcado directo al AusUDID
- Actualización de los registros UDI existentes
Normas especiales para equipos existentes
Un aspecto importante de la regulación australiana de UDI se refiere a los dispositivos ya fabricados:
Solo para productos sanitarios de clase III y IIb:
- Equipos fabricados y etiquetados antes del 1 de julio de 2026
- ¿Se encuentran todavía bajo control de patrocinio el 1 de julio de 2029?
- Deben volver a etiquetarse de acuerdo con el UDI antes de esta fecha
Excepciones:
- Los dispositivos ya entregados a hospitales, distribuidores o pacientes están exentos de los requisitos de UDI de por vida
- Otras clases de dispositivos (IIa, Is) están exentas del requisito de reetiquetado
Reacondicionamiento y reacondicionamiento
Se debe prestar especial atención a los dispositivos reacondicionados:
Reprocesamiento por otro fabricante:
- Se considera un nuevo dispositivo con todos los requisitos de UDI
- Requiere nueva inclusión en ARTG
- Debe cumplir con los requisitos de UDI en la fecha de cumplimiento relevante
Reprocesamiento por el fabricante original:
- Puede suministrarse bajo la ARTG existente (en caso de que no se modifique el uso previsto)
- En caso de cambio de finalidad: se considera un dispositivo nuevo
- Los requisitos de marcado directo se aplican sin excepción
Normas especiales para los certificados de la UE
Para los productos comercializados bajo certificados MDD/IVDD de la UE en Australia, se aplican períodos de transición extendidos acordadoscon la transición MDR/IVDR de la UE:
Dispositivos médicos con certificados MDD de la UE:
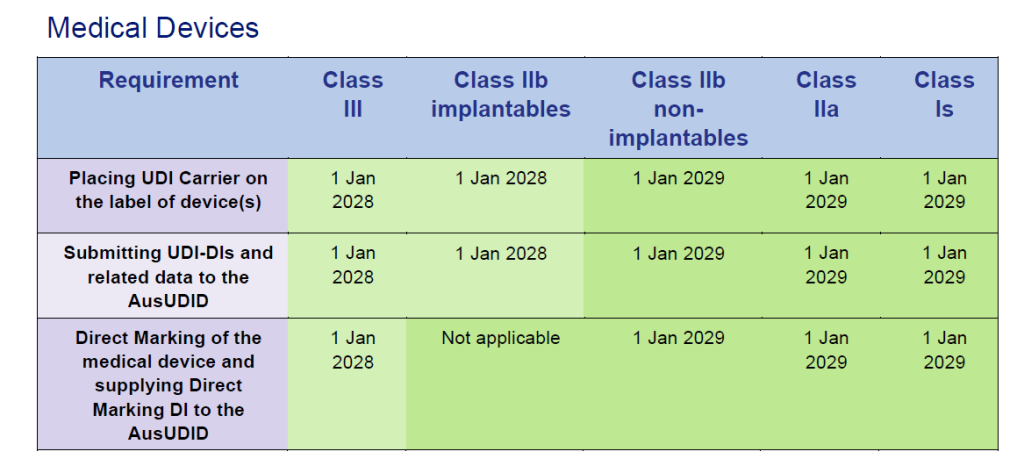
Fuente: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
IVD bajo certificados IVDD de la UE:
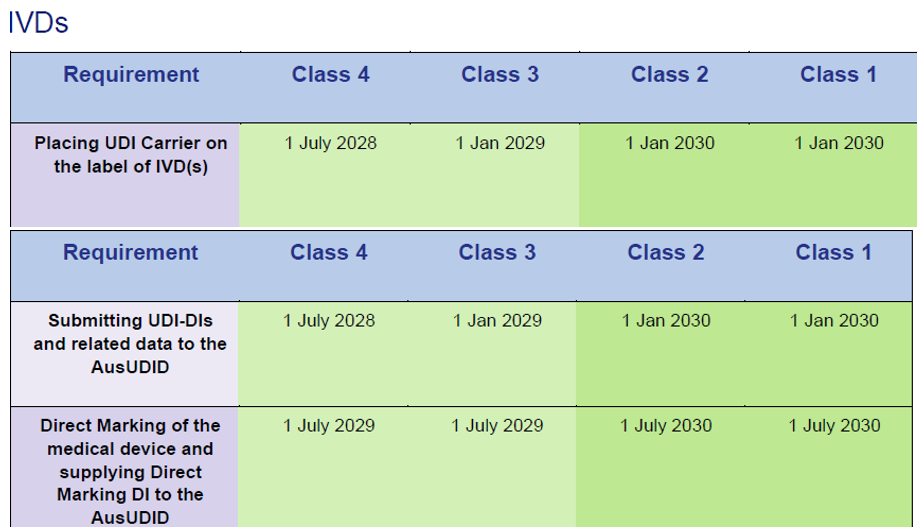
Fuente: Timeframes for supplying UDI compliant medical devices in Australia, versión 1.0 March 2025
Importante: Tan pronto como sus productos se conviertan a certificados MDR/IVDR de la UE, se aplicarán las fechas de cumplimiento estándar australianas.
Información importante
- La implementación voluntaria es posible incluso antes de las fechas vinculantes y se recomienda
- Dispositivos existentes: los dispositivosde clase III y IIb deben ser reetiquetados antes del 1 de julio de 2029, si aún están bajo control del patrocinador.
- Transmisión de datos: los datos UDI deben transmitirse dentro de los 30 días posteriores a la comercialización
- Nuevas solicitudes bajo MDD: se requiere prueba de la autorización de renovación de la UE
Nuestra recomendación
Comience la preparación con antelación:
- Compruebe la clasificación de su equipo
- Preparar etiquetas UDI
- Pruebe sus métodos de transmisión de datos
- Tenga en cuenta las disposiciones transitorias de la UE
Póngase en contacto con nosotros para un asesoramiento individual sobre sus requisitos de UDI.
Pasos prácticos para la preparación
1. Inventario y clasificación
- Registro completo de todos los productos comercializados en Australia
- Confirmación de la clasificación del dispositivo
- Identificación de las fechas de cumplimiento relevantes
- Comprobación de los certificados de la UE existentes y su período de validez
2. Preparación técnica
- Selección de un proveedor de UDI acreditado (GS1, HIBCC, ICCBBA)
- Desarrollo de la estrategia de etiquetado UDI
- Adaptación del etiquetado y embalaje
- Preparación del marcado directo (si es necesario)
3. Gestión de datos
- Estructura de los registros UDI con toda la información necesaria
- Prueba de los métodos de transmisión de datos (portal en línea, carga masiva, máquina a máquina)
- Integración en los sistemas ERP y de gestión de calidad existentes
- Formación del personal responsable
4. Cumplimiento normativo
- Vinculación con entradas ARTG
- Preparación de los procesos de seguimiento post-mercado
- Integración en los procedimientos de notificación de eventos adversos
- Documentación de todos los procesos relacionados con el UDI
Riesgos por incumplimiento
La TGA ha anunciado claras consecuencias en caso de incumplimiento de los requisitos de UDI:
- Suspensión o cancelación de equipos del Registro Australiano de Bienes Terapéuticos (ARTG)
- Penas civiles en virtud de la Parte 4-11, División 1 de la Ley de Bienes Terapéuticos
- Advertencias y multas
Lasexenciones (consentimiento para el suministro) solo son posibles en circunstancias excepcionales y por períodos limitados. Las solicitudes deben presentarse a tiempo antes de la fecha límite de cumplimiento.
Implementación temprana voluntaria
La TGA recomienda expresamente la implementación temprana voluntaria de los requisitos de UDI:
Ventajas:
- Reducción de la confusión entre los usuarios finales (personal sanitario, hospitales, pacientes)
- Identificación temprana y solución de problemas de implementación
- Mejor distribución de la carga de trabajo
- Ventaja competitiva gracias al cumplimiento temprano
Recomendación: En caso de implementación voluntaria, se deben cumplir plenamente todos los requisitos de UDI para evitar incoherencias.







Related Posts