1 Mrd. € für KI

EU startet „Apply AI": 1 Mrd. € für KI in Schlüsselbranchen – Fokus auch auf Gesundheitswesen Die EU-Kommission bringt mit „Apply AI" ein Investitionspaket von 1 Mrd. € auf den…

EU startet „Apply AI": 1 Mrd. € für KI in Schlüsselbranchen – Fokus auch auf Gesundheitswesen Die EU-Kommission bringt mit „Apply AI" ein Investitionspaket von 1 Mrd. € auf den…
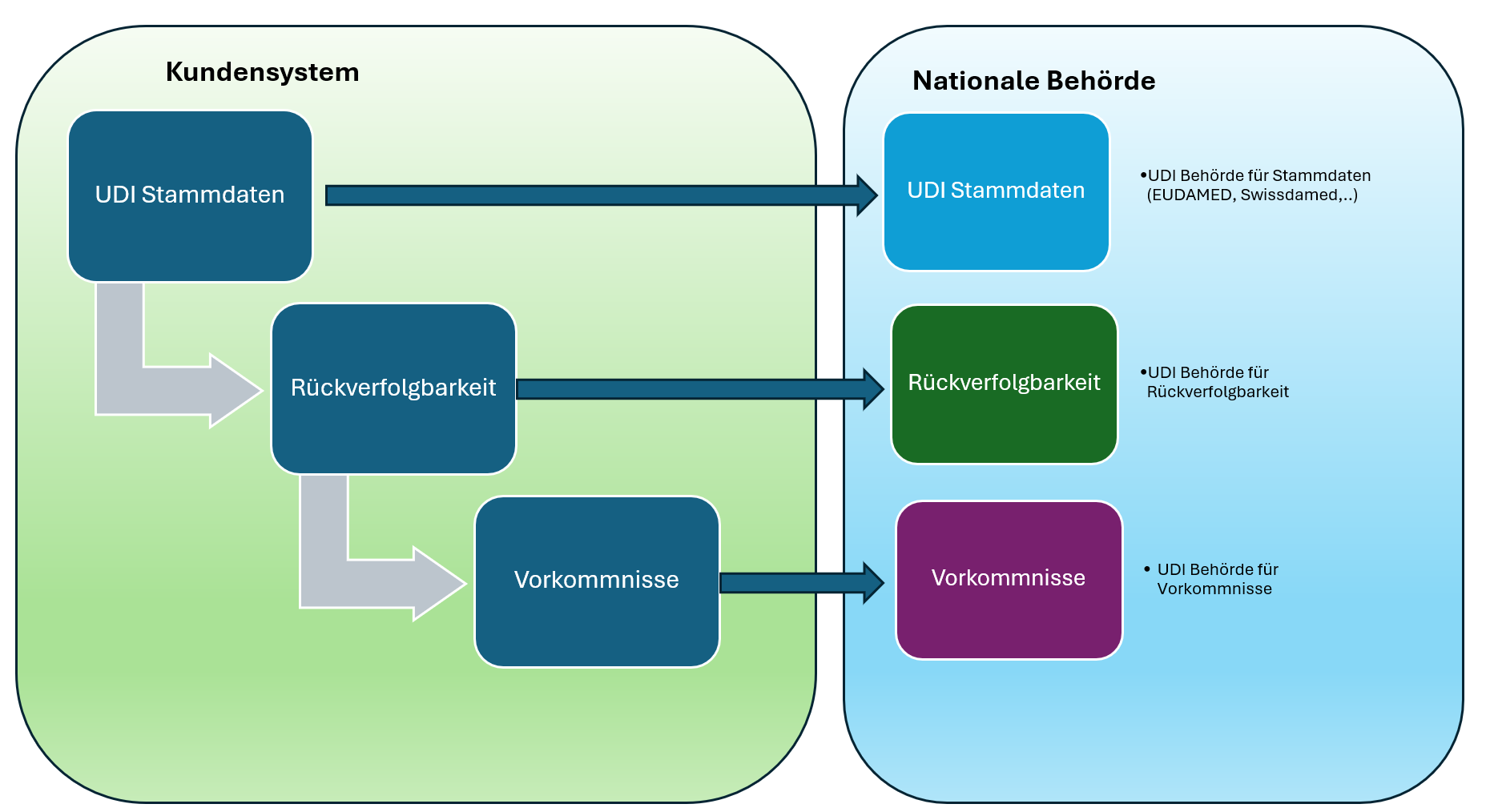
Der komplette Lifecycle im UDI-Umfeld – alles aus einer Hand Der Weg zur vollständigen UDI-Compliance lässt sich als Datenkreislauf verstehen: UDI-Stammdaten → Rückverfolgbarkeit → Vigilanz Jeder Baustein ist wichtig, doch…

Wann muss der UDI-DI-Status umgestellt werden? In EUDAMED entscheidet der Status (nicht die Länder-Enddaten), ob ein Gerät als „On the EU market“ oder „No longer placed on the EU market“…
Müssen Sonderanfertigungen (Custom-made devices /CMD) in EUDAMED registriert werden – und wie ist das bei Vigilanzfällen? Was sind Sonderanfertigungen laut MDR? Bitte lesen Sie hierzu auch unseren Artikel Sonderanfertigung gemäß…
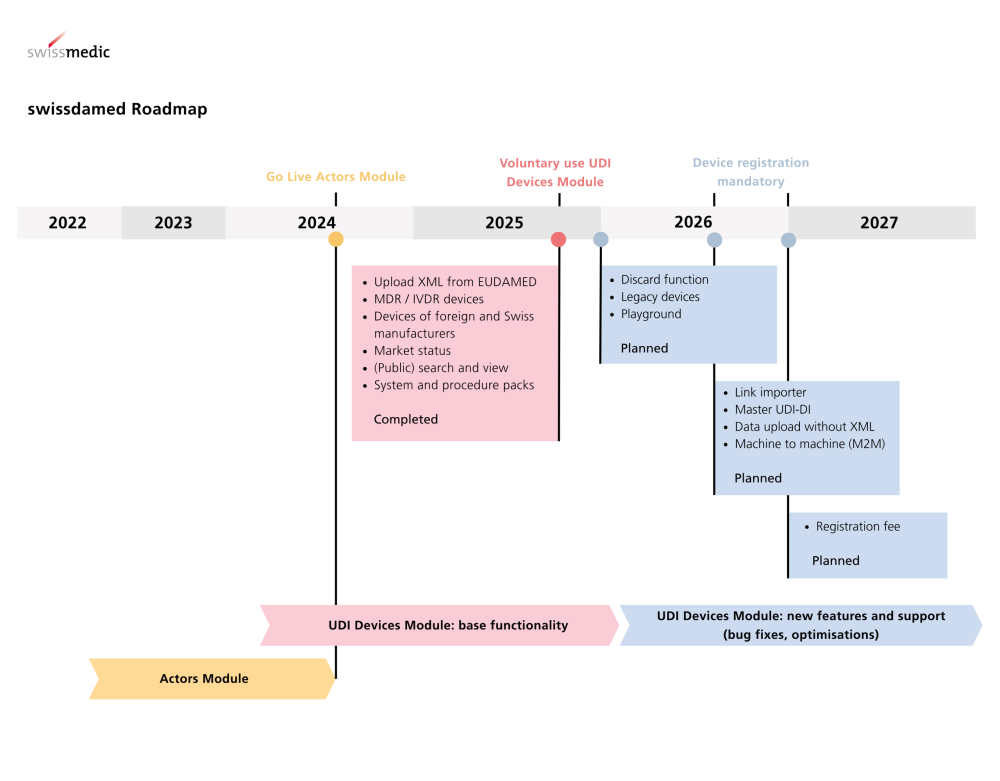
UDI-Devices-Modul live Swissmedic erweitert die nationale Medizinprodukte-Datenbank um eine zentrale Funktionalität. Das UDI-Devices-Modul in swissdamed ist seit dem 18. August 2025 live. Ab sofort können Medizinprodukte, In-vitro-Diagnostika sowie Systeme und…

Europe IT Consulting erfolgreich nach ISO 9001:2015 rezertifiziert Am 6. August 2025 fand bei Europe IT Consulting GmbH die Rezertifizierung durch die QS Zürich AG statt. Der Auditbericht bestätigt die…
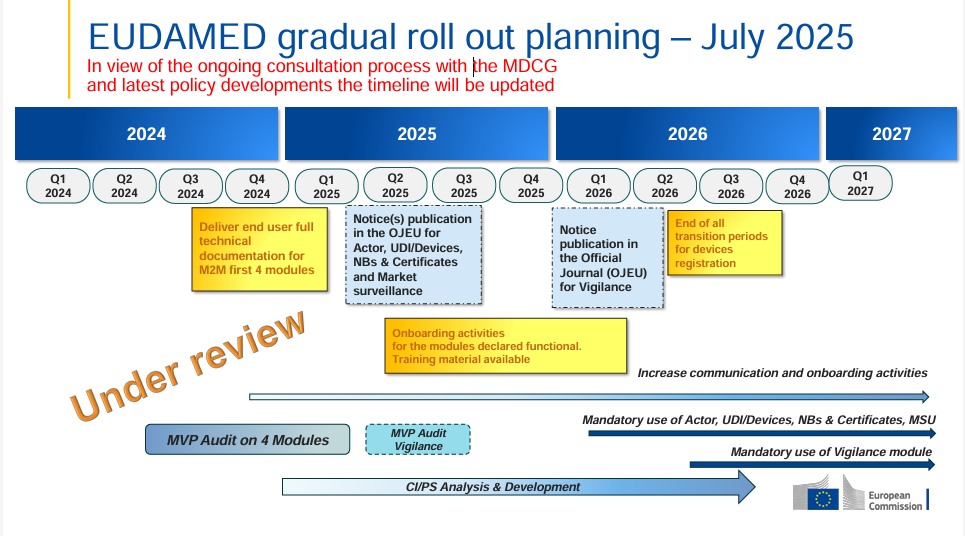
Die Europäische Kommission hat den EUDAMED-Rollout-Plan aktualisiert (Juli 2025) – und dieses Mal mit einem klaren Hinweis: Der Zeitplan steht „under review“. Das bedeutet, dass aktuell im Rahmen eines MDCG‑Konsultationsprozesses politische…
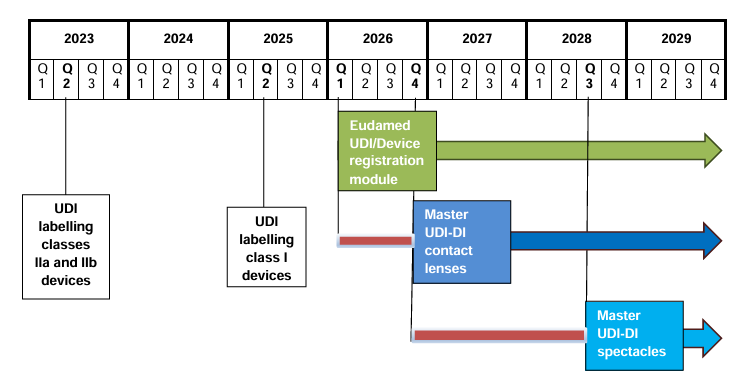
MDCG veröffentlicht Zeitplan zur Einführung der Master UDI-DI für Sehhilfen und Kontaktlinsen Die Medical Device Coordination Group (MDCG) hat mit dem Positionspapier MDCG 2025-7 die verbindlichen Zeitpläne für die Einführung…

Executive Summary Die Türkei entwickelt sich zu einem wichtigen Absatzmarkt für Medizinprodukte mit einer Bevölkerung von 85 Millionen Einwohnern und einer wachsenden Gesundheitswirtschaft. Der Medizintechnik-Markt zeigt trotz wirtschaftlicher Herausforderungen positive…

Was ist eMDR? eMDR (Electronic Medical Device Reporting) ist das elektronische Meldesystem der US-amerikanischen FDA für Vigilanzfälle im Zusammenhang mit Medizinprodukten. Dieses System ermöglicht die strukturierte und standardisierte Meldung von unerwünschten Ereignissen, Gerätedefekten und…