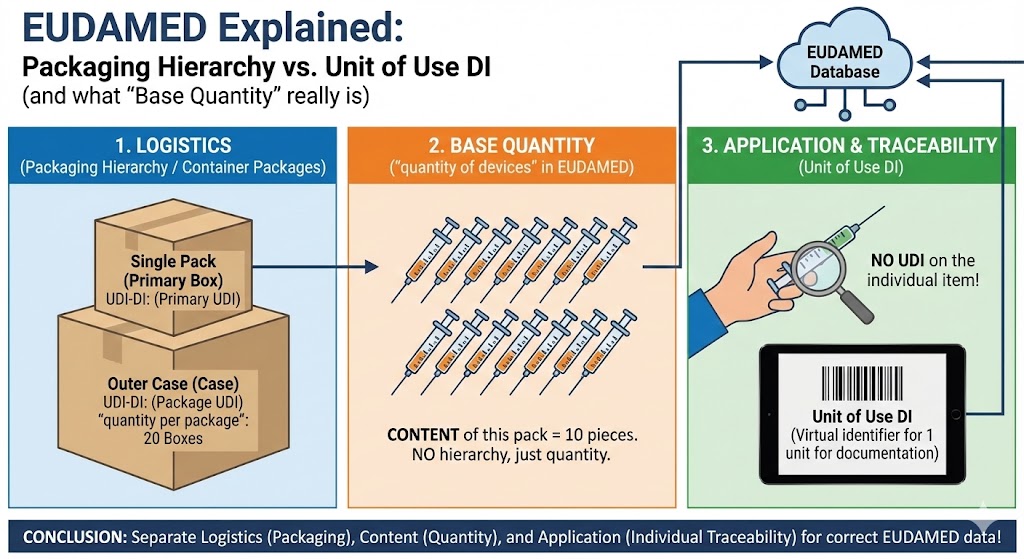
UDI (Unique Device Identification) ist ein weltweit einheitliches System zur Identifikation von Medizinprodukten ...................

UDI der FDA und EU
Hersteller medizinischer Geräte haben grösstenteils die Anforderungen der FDA bereits realisiert. Nun steht die Fertigstellung der Europäischen Datenbank, kurz EUDAMED, an und bringt neue Anforderungen mit sich.