Die Einführung der Medizinprodukteverordnung brachte eine bedeutende Veränderung mit sich: die Zuweisung von Unique Device Identifiers (UDIs) für medizinische Geräte.
Dieser Schritt wurde unternommen, um die Identifizierung, Rückverfolgbarkeit und Überwachung von Medizinprodukten zu verbessern und gleichzeitig Fälschungen entgegenzuwirken. Ein wichtiger Meilenstein auf diesem Weg ist die Implementierung des sogenannten Master UDI-DI.
Was ist der Master UDI-DI ?
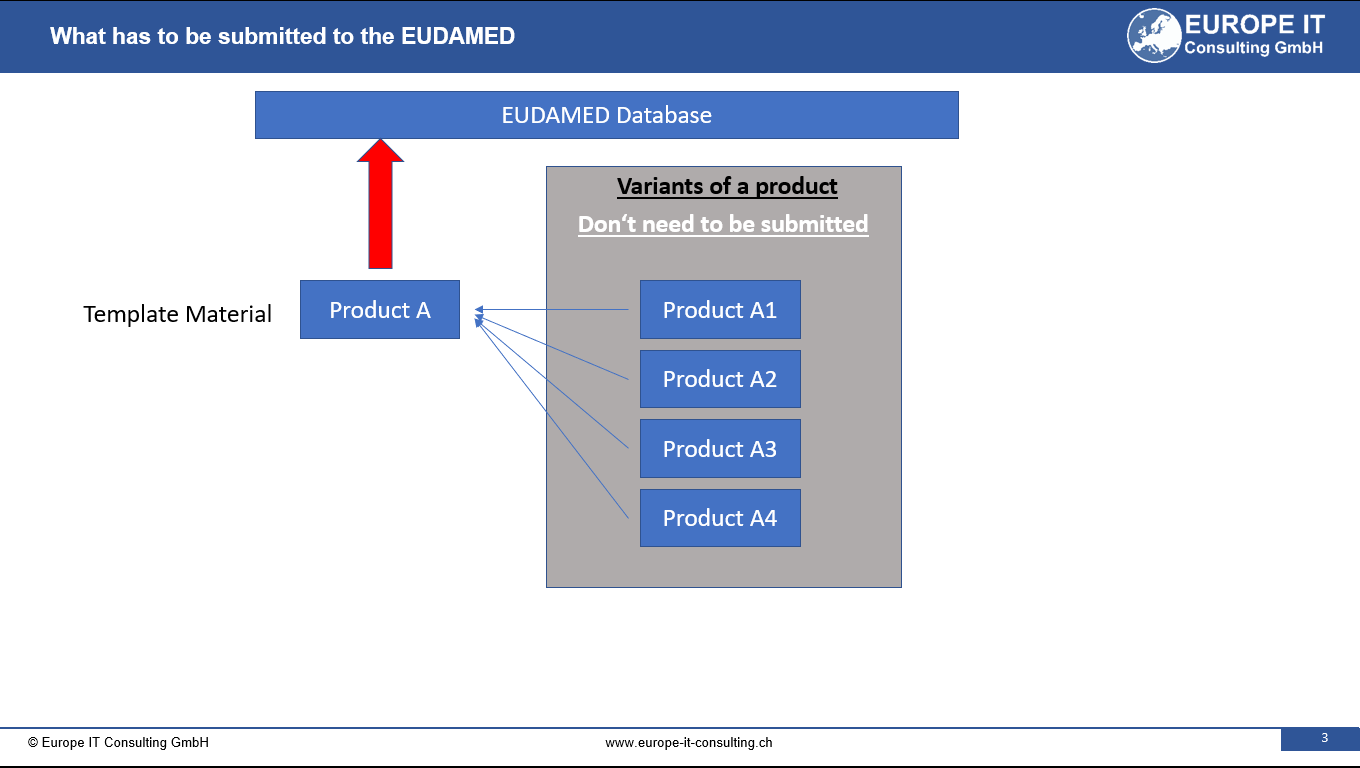
Sein Hauptziel besteht darin, eine zusätzliche Ebene der Identifizierung für spezifische Produkte und Medizinprodukte zu schaffen. Diese innovative Herangehensweise ermöglicht eine effizientere Gruppierung von hoch individualisierten Geräten und reduziert dadurch die Menge der Dateneinträge in der EUDAMED-Datenbank (UDI-Modul).
Die Hauptgeschäftsherausforderung des Master UDI-DI liegt in der effektiven Kategorisierung von stark individualisierten Geräten. Diese Herangehensweise resultiert nicht nur in einer verringerten Dateneintragsmenge in der EUDAMED-Datenbank, sondern unterstützt auch die Bereitstellung von detaillierteren Produktinformationen mithilfe zusätzlicher Anwendungsidentifikatoren für klinische Spezifikationen.
Umsetzung und Nutzen
Der Master UDI-DI wird als Produktidentifikator (PI) im UDI-Barcode auf der Verpackung oder dem Etikett des Produkts angebracht. Die präzisen Spezifikationen und Anforderungen für den Master UDI-DI wurden möglicherweise von der EUDAMED (Europäische Datenbank für Medizinprodukte) zum aktuellen Zeitpunkt noch nicht abschließend festgelegt.
Die ersten Produktkategorien, die den Master UDI-DI erfordern, umfassen Kontaktlinsen, Brillengläser und Fertiglesegeräte. Dennoch ist es wichtig zu betonen, dass die Liste der Produkte mit einem hohen Grad an Individualisierung in Zukunft erweitert werden könnte.

Die Implementierung des Master UDI-DI mag wie eine zusätzliche Hürde erscheinen, jedoch spielt sie eine essenzielle Rolle im Prozess der Identifikation und Rückverfolgbarkeit von Medizinprodukten.
Diese Maßnahme unterstreicht das fortwährende Streben nach höherer Sicherheit, Qualität und Effizienz im Bereich der Medizinprodukte.
Aktuelle Entwicklungen zur Master UDI-DI in EUDAMED
Mit dem neuesten Update der EUDAMED-Testumgebung (Playground) wurde ein wichtiger Schritt zur konkreten Umsetzung der Master UDI-DI-Funktionalität gemacht. Hersteller können jetzt bestimmte hoch individualisierte Produkte – wie beispielsweise Standard-Kontaktlinsen, formstabile RGP-Linsen oder individuell gefertigte Brillengläser – unter einer Master UDI-DI registrieren.
Diese Erweiterung ermöglicht es Unternehmen, die große Stückzahlen dieser Produktarten vertreiben, nur eine einzige Master UDI-DI für eine gesamte Produktfamilie zu verwenden – anstatt jede einzelne Variante separat einzutragen.

Neues Menüelement für Master UDI-DI in der EUDAMED-Testumgebung.
Wann ist eine Master UDI-DI erforderlich?
Die Pflicht zur Anlage einer Master UDI-DI wird durch bestimmte Kriterien ausgelöst:
-
Die Produkte gehören zur gleichen generischen Produktgruppe.
-
Sie weisen individuelle Spezifikationen auf (z. B. Sehstärke, Krümmung, Zylinder).
-
Sie sind nach dem gleichen MDR-Regelwerk klassifiziert.
-
Sie unterliegen denselben Risiken und klinischen Bewertungen.
Beispiel:
Ein Hersteller von Kontaktlinsen kann alle Varianten eines bestimmten Typs (z. B. Monatslinsen mit verschiedenen Stärken) unter einer Master UDI-DI registrieren.

Auswahl der Produkttypen – z. B. „Standard soft contact lenses“

Gesamtauswahl mit Hinweis: „Registration is not possible currently …“

Fokus auf Linsentypen, inkl. „Standard soft contact lenses“
💡 Hinweis: Diese Option ist aktuell nur in der Testumgebung verfügbar. Der Livegang der Funktion wird nach Abschluss weiterer Tests erwartet.
EUDAMED-Eingabemaske: Gleich, aber erweitert
Zwar ändert sich der Menüpunkt bei der Auswahl einer Master UDI-DI, die zugrunde liegenden Felder und Anforderungen entsprechen jedoch denen anderer MDR-Produkte. Die Eingabemaske bleibt somit vertraut, was die Einarbeitung erleichtert.

Eingabe der Master UDI-DI und zugehöriger Ausgabestelle.

Merkmale wie Single-Use, Reuse und Sterilisation vor Gebrauch.
Unsere Unterstützung für Hersteller
Europe IT Consulting begleitet Hersteller aktiv bei der korrekten Umsetzung der Master UDI-DI-Pflichten:
-
Prüfung der Eignung von Produkten für eine Master UDI-DI
-
Bereitstellung konformer Excel-Vorlagen zur UDI-Erfassung
-
Automatisierte XML-Generierung für EUDAMED
-
Testübertragungen in der EUDAMED-Playground-Umgebung
-
Schulungen und individuelle Beratung









Related Posts