EUDAMED: Vier Module ab 28. Mai 2026 verpflichtend
Die Europäische Kommission hat mit der Veröffentlichung der Kommissionsentscheidung (EU) 2025/2371 im Amtsblatt der EU (OJEU) am 27. November 2025 offiziell bestätigt, dass die ersten vier EUDAMED-Module funktionsfähig sind. Damit startet eine Übergangsfrist von sechs Monaten:
Ab dem 28. Mai 2026 ist die Nutzung dieser Module verpflichtend
Es handelt sich um folgende Module:
-
Actor Registration
-
UDI / Device Registration
-
Notified Bodies & Certificates
-
Market Surveillance
Parallel dazu bereitet die Europäische Kommission Hersteller und weitere Wirtschaftsakteure in Onboarding-Trainings auf die verpflichtende Nutzung vor – unter anderem mit Fokus auf das UDI/Device-Modul.
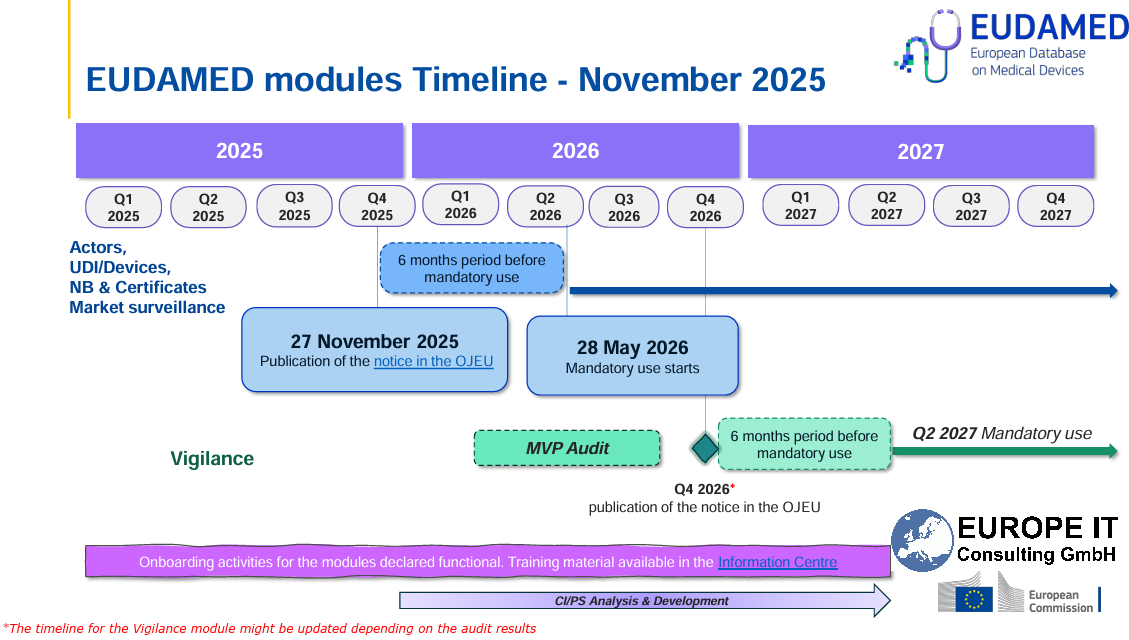
Zeitplan im Überblick
Die offizielle EUDAMED-Roadmap (Stand: November 2025) zeigt folgenden Zeitplan:
-
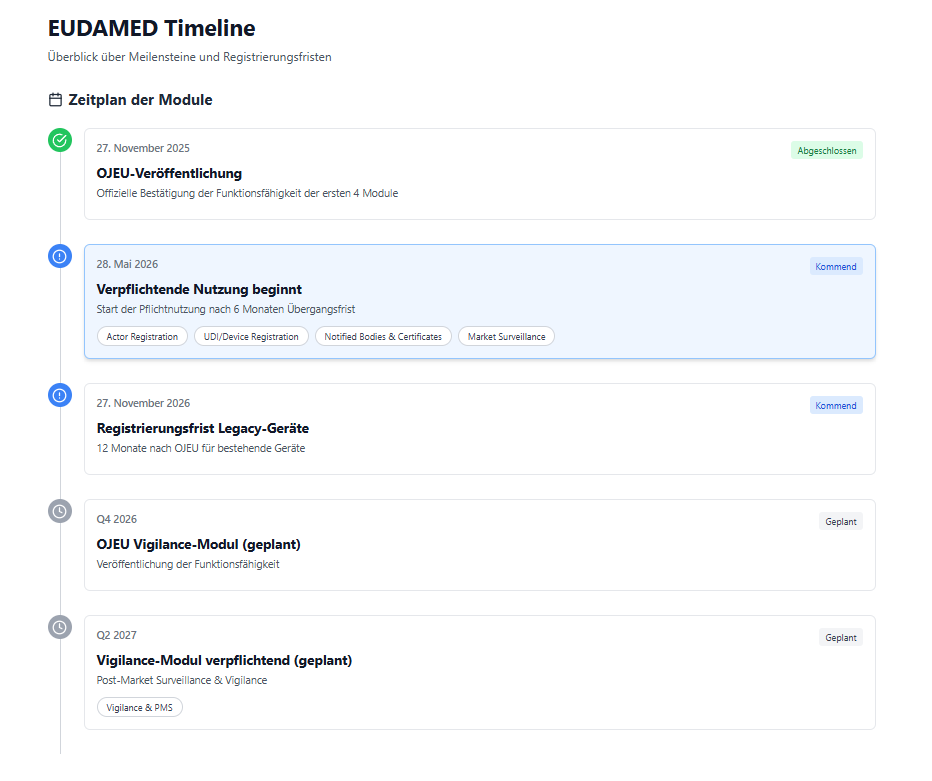
27. November 2025
Veröffentlichung der Funktionsfähigkeits-Mitteilung im Amtsblatt der EU (OJEU) für die ersten vier Module -
28. Mai 2026
Beginn der verpflichtenden Nutzung der Module-
Actor Registration
-
UDI/Device Registration
-
Notified Bodies & Certificates
-
Market Surveillance
-
-
Q4 2026 (geplant)
Veröffentlichung der Funktionsfähigkeits-Mitteilung für das Vigilance-/Post-Market-Surveillance-Modul -
Q2 2027 (geplant)
Verpflichtende Nutzung des Vigilance-Moduls
Die beiden verbleibenden Module – Post-Market Surveillance & Vigilance sowie Clinical Investigations & Performance Studies – werden laut Europäischer Kommission erst dann freigeschaltet, wenn ihre Nutzung unmittelbar verpflichtend wird, ohne vorherige freiwillige Phase.
Registrierungsfristen je nach Gerätetyp

Die Übergangsfristen unterscheiden danach, wann ein Gerät erstmals in der EU in Verkehr gebracht wurde. Die Europäische Kommission erläutert dies in ihrem Q&A-Dokument zum EUDAMED-Roll-out.
1. Neue MDR/IVDR-Geräte (Regulation Devices)
Geräte, die ab dem 28. Mai 2026 erstmals in der EU in Verkehr gebracht werden:
-
Die Registrierung im UDI/Device-Modul muss vor dem ersten Inverkehrbringen erfolgen.
-
Ohne UDI/Device-Registrierung darf das Produkt nicht auf den Markt gebracht werden.
2. Legacy-Geräte und bestehende MDR/IVDR-Geräte
Geräte, die bereits vor dem 28. Mai 2026 auf dem Markt sind (Legacy unter MDD/AIMDD/IVDD oder bereits nach MDR/IVDR konforme Produkte):
-
Es gilt eine Übergangsfrist von 12 Monaten ab Veröffentlichung der OJEU-Mitteilung.
-
Bei einer OJEU-Veröffentlichung am 27. November 2025 bedeutet das:
Registrierung dieser Geräte im UDI/Device-Modul spätestens bis 27. November 2026.
3. Geräte, die nicht mehr in Verkehr gebracht werden
Legacy- oder Regulation-Geräte, die vor dem 28. Mai 2026 endgültig vom Markt genommen wurden, aber weiterhin in der Vertriebskette zirkulieren:
-
Keine grundsätzliche Pflicht zur Registrierung im UDI/Device-Modul,
-
es sei denn, es tritt ein Vigilanz- oder PMS-Ereignis auf, das nach Start der verpflichtenden Nutzung des Vigilance-Moduls über EUDAMED gemeldet werden muss (erwartet ab Q2 2027).
Was bedeutet das für Hersteller konkret?
Für Hersteller, Importeure und Bevollmächtigte ergeben sich daraus mehrere dringende Handlungsfelder:
1. Actor Registration (SRN) absichern
-
Prüfen, ob alle relevanten Wirtschaftsakteure (Hersteller, Bevollmächtigte, Importeure, ggf. System- und Prozedurenpaket-Hersteller) bereits als Actor in EUDAMED registriert und freigeschaltet sind.
-
Ohne Actor-Registrierung ist keine Geräte-Registrierung und später kein Melden von Vigilanzfällen in EUDAMED möglich.
2. UDI- und Stammdaten strukturieren
-
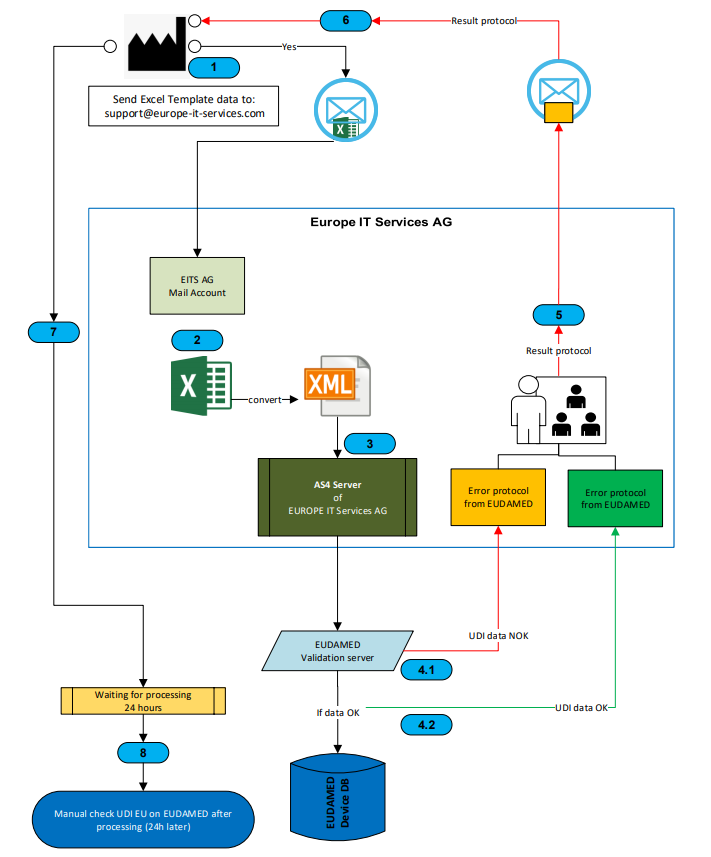
UDI-/Stammdaten so aufbereiten, dass sie EUDAMED-konform in Excel/XML exportiert und im UDI/Device-Modul registriert werden können – manuell, als Bulk-Upload oder via M2M-Schnittstellen.
-
Datenquellen harmonisieren (ERP/SAP, PLM, Excel-Listen, Labeling-Systeme etc.).
3. Portfolio nach Gerätetypen clustern
-
Unterscheiden zwischen:
-
neuen MDR/IVDR-Geräten (Registrierung vor Markteintritt ab 28.05.2026),
-
bestehenden MDR/IVDR-Geräten & Legacy-Geräten mit weiteren Verkäufen (Registrierung bis 27.11.2026),
-
Geräten, die nicht mehr in Verkehr gebracht werden (nur Registrierung im Zusammenhang mit Vigilanz-/PMS-Fällen).
-
4. Von „Projekt“ zu „Prozess“ denken
-
EUDAMED ist keine einmalige Upload-Aktion, sondern ein laufender Prozess:
-
neue Produkte
-
Produktänderungen und Re-Zertifizierungen
-
Zertifikats-Updates über das NB/Certificates-Modul
-
Vigilanz- und PMS-Meldungen nach Go-Live des Vigilance-Moduls
-
Wie Europe IT Consulting Sie unterstützen kann
Europe IT Consulting unterstützt Hersteller dabei, die Übergangszeit bis zur verpflichtenden Nutzung von EUDAMED optimal zu nutzen – von der ersten Bestandsaufnahme bis zur automatisierten Übertragung:
-
EUDAMED Readiness Check
Kurze Analyse von SRNs, UDI-/Stammdaten, Systemlandschaft (z. B. SAP, Excel) und EUDAMED-Strategie (Excel-Templates, SAP-Add-on, M2M-Anbindung, Cloud-Portal). -
Daten- und Prozessdesign für UDI & EUDAMED
Strukturierung der UDI-Datenmodelle, Definition der Pflicht- und Kann-Felder pro Behörde und Auslegung eines skalierbaren Registrierungsprozesses. -
Technische Umsetzung
Anbindung von SAP-Systemen und anderen Quellsystemen an EUDAMED (z. B. über das Global UDI Framework / UDI-Add-ons oder ein zentrales Global Submission Portal für Excel-zu-XML-Konvertierung und Multi-Authority-Submissions). -
Schulung & Change Management
Praxisnahe Trainings für Regulatory Affairs, Qualitätsmanagement und IT zu UDI-Strukturen, EUDAMED-Workflows und Rollenmodellen.





Related Posts