Seasonal Greetings

Frohe Weihnachten und einen guten Start ins Jahr 2026! Ein intensives Jahr neigt sich dem Ende zu – mit vielen Projekten rund um UDI, EUDAMED, FDA GUDID & Co. Gemeinsam…

Frohe Weihnachten und einen guten Start ins Jahr 2026! Ein intensives Jahr neigt sich dem Ende zu – mit vielen Projekten rund um UDI, EUDAMED, FDA GUDID & Co. Gemeinsam…
UDI Excel Cloud Validator von Europe IT Consulting GmbH jetzt im SAP® Store verfügbar Durch die Integration mit der SAP Business Technology Platform (SAP BTP) bietet der UDI Excel Cloud…
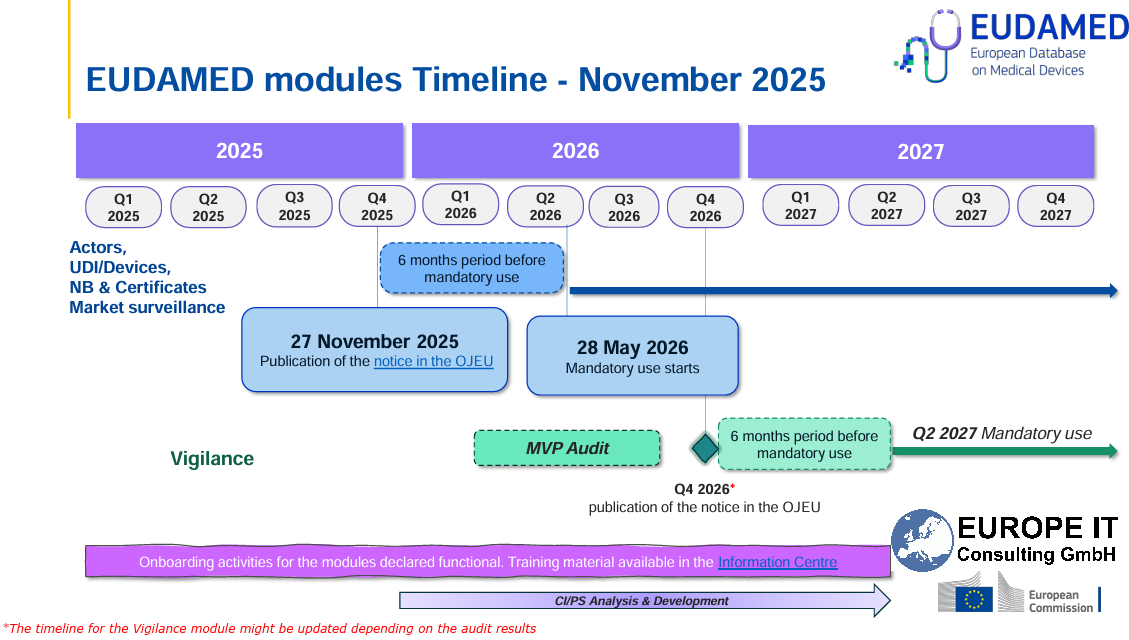
EUDAMED: Vier Module ab 28. Mai 2026 verpflichtend Die Europäische Kommission hat mit der Veröffentlichung der Kommissionsentscheidung (EU) 2025/2371 im Amtsblatt der EU (OJEU) am 27. November 2025 offiziell bestätigt,…
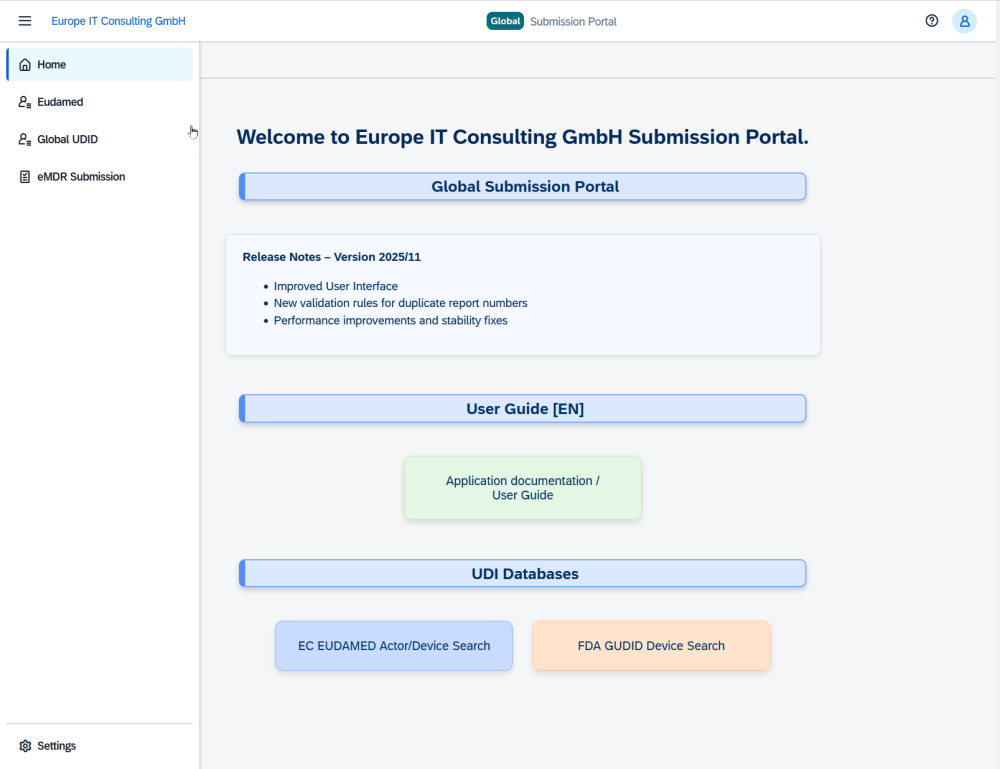
Europe IT Consulting stellt das Global Submission Portal mit Fokus auf FDA eMDR vor Neue Cloud-Plattform bündelt eMDR, GUDID und EUDAMED in einem System Mit dem Global Submission Portal bringt…

Save the Date: regularia 2026 – Europe IT Consulting ist dabei Am 3. März 2026 findet in der Stadthalle Tuttlingen erstmals die regularia statt – das neue Regulatorik-Forum für die…

Was Kontaktlinsen-Hersteller jetzt über die Master UDI-DI wissen müssen Die Medical Device Coordination Group (MDCG) hat Ende August 2025 die überarbeitete Leitlinie MDCG 2024-14 Rev.1 veröffentlicht. Sie behandelt die praktische…
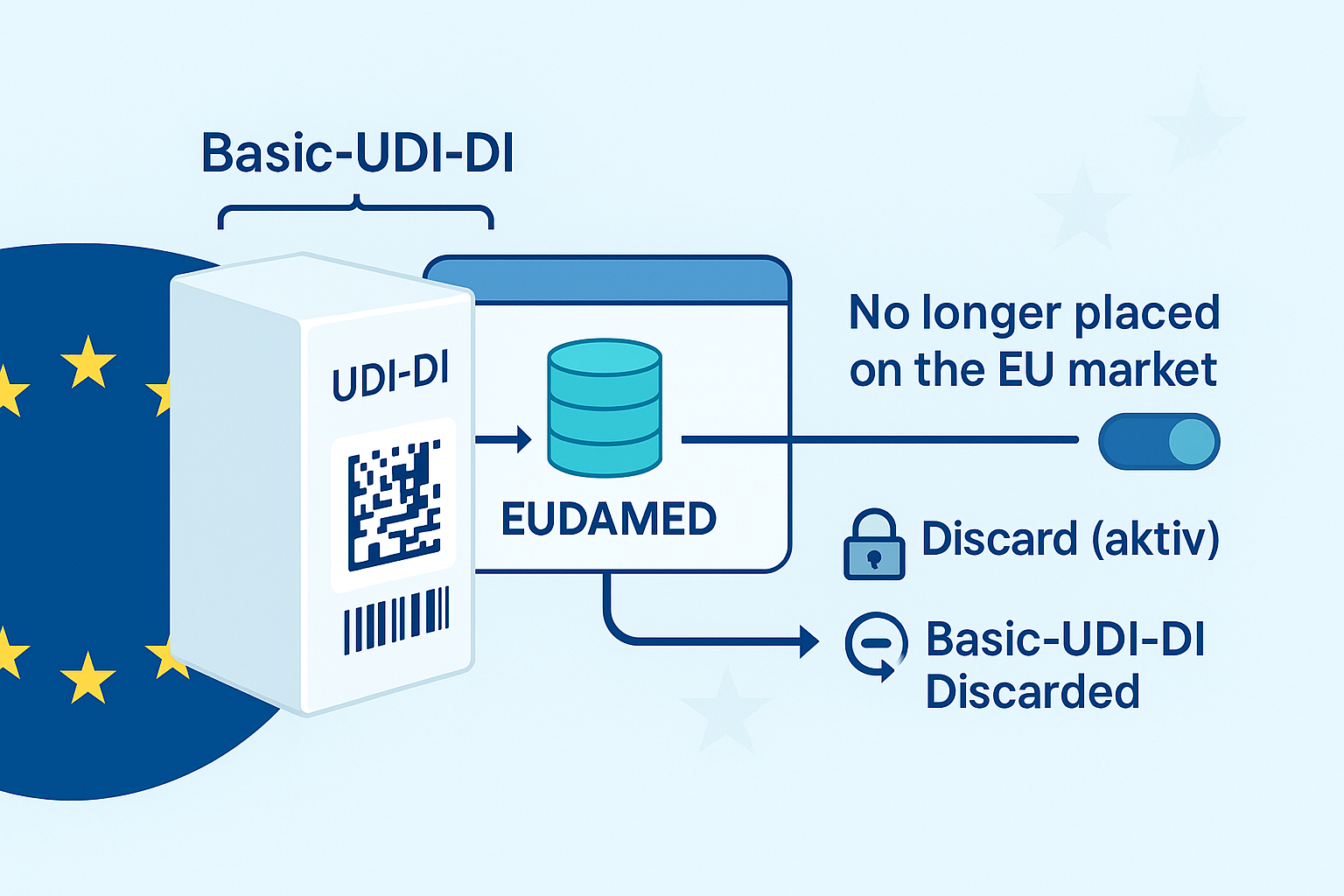
Basic-UDI-DI in Übergangsszenarien: Darf eine BUDI „leer“ sein? 1. Kann eine Basic-UDI-DI (übergangsweise) ohne zugehörige UDI-DI(s) bestehen? Nein – in EUDAMED wird eine Basic-UDI-DI nicht isoliert registriert. Bei der Registrierung…

EU startet „Apply AI": 1 Mrd. € für KI in Schlüsselbranchen – Fokus auch auf Gesundheitswesen Die EU-Kommission bringt mit „Apply AI" ein Investitionspaket von 1 Mrd. € auf den…
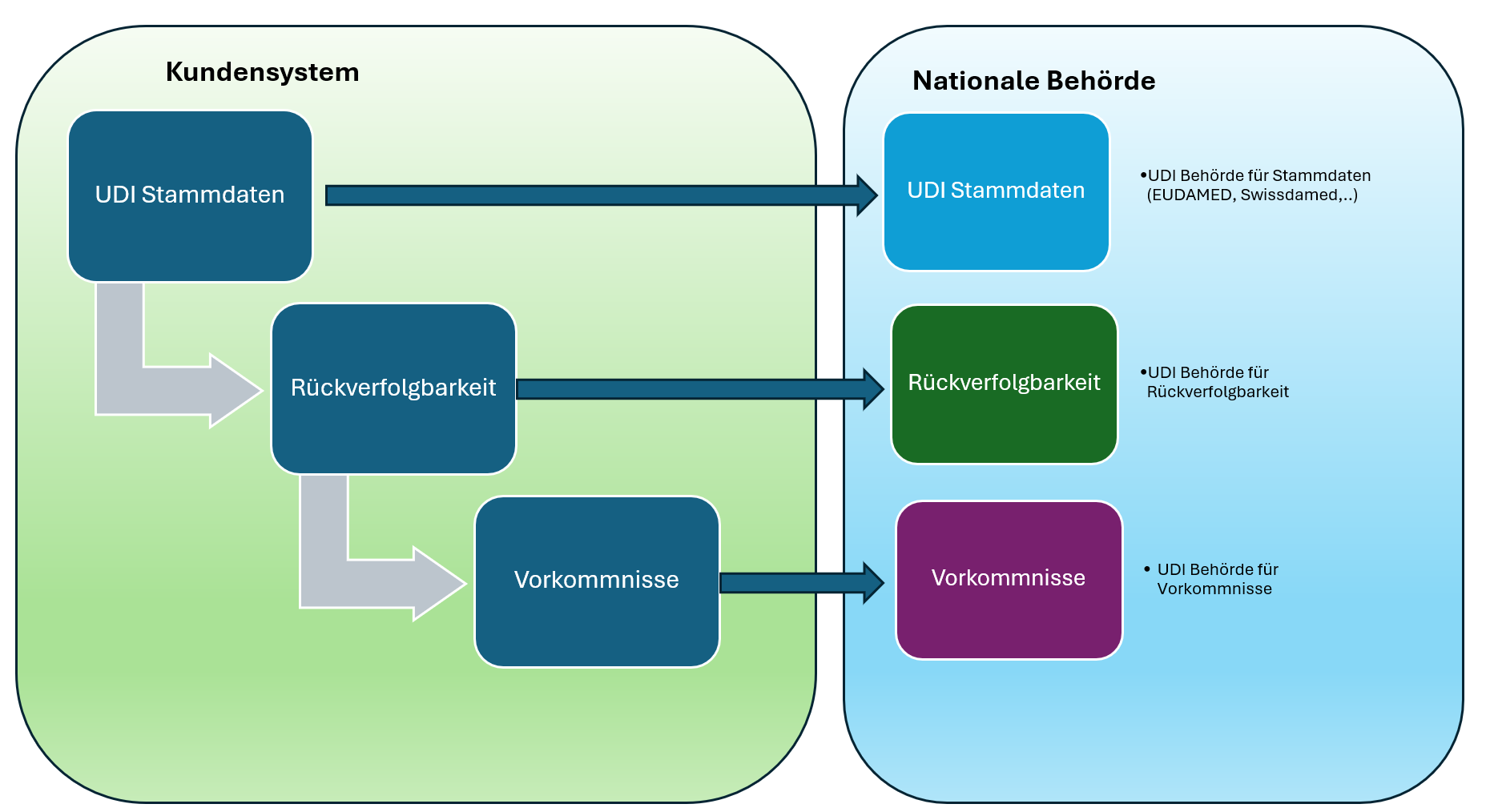
Der komplette Lifecycle im UDI-Umfeld – alles aus einer Hand Der Weg zur vollständigen UDI-Compliance lässt sich als Datenkreislauf verstehen: UDI-Stammdaten → Rückverfolgbarkeit → Vigilanz Jeder Baustein ist wichtig, doch…

Wann muss der UDI-DI-Status umgestellt werden? In EUDAMED entscheidet der Status (nicht die Länder-Enddaten), ob ein Gerät als „On the EU market“ oder „No longer placed on the EU market“…