
Neue Zeitpläne für die Unique Device Identification (UDI) in Australien
Die australische Therapeutic Goods Administration (TGA) hat die verbindlichen Zeitpläne für die Einführung der UDI-Anforderungen bekannt gegeben. Das UDI-System ist Teil der australischen Strategie zur Stärkung der Patientensicherheit und schließt sich dem global harmonisierten Ansatz zur präzisen Identifizierung von Medizinprodukten an.
Hintergrund und Bedeutung
Mit der Einführung des australischen UDI-Systems wird eine bessere Rückverfolgbarkeit von Medizinprodukten ermöglicht. Dies unterstützt insbesondere:
- Post-Market-Überwachung: Effizientere Verwaltung von Sicherheitswarnungen und Rückrufen
- Patientensicherheit: Verbesserte Identifizierung bei Implantaten und kritischen Geräten
- Regulatorische Effizienz: Harmonisierung mit internationalen Standards
- Datenqualität: Einheitliche und zuverlässige Gerätedaten im AusUDID (Australian Unique Device Identification Database)
Die Umsetzung erfolgt risikoorientiert über 5 Jahre, beginnend mit Hochrisiko-Medizinprodukten, um Herstellern und Sponsoren ausreichend Vorbereitungszeit zu gewähren.
Compliance-Zeitpläne für Medizinprodukte
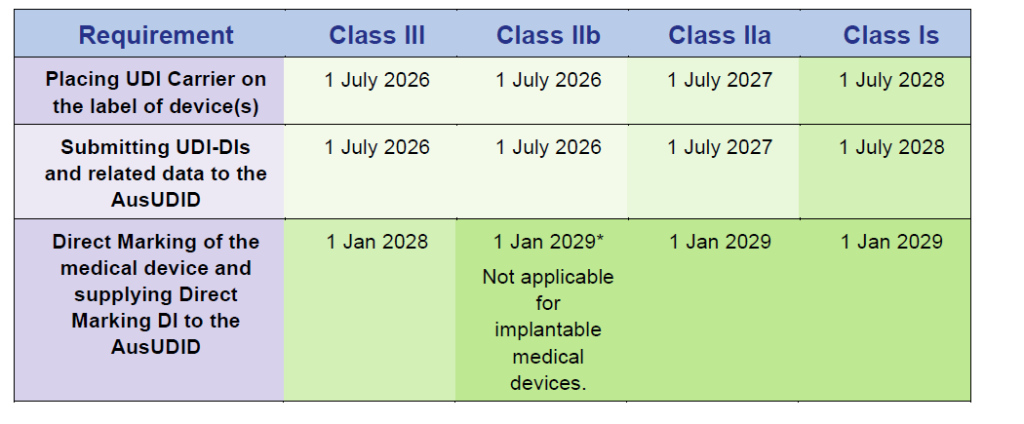
Quelle: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
Compliance-Zeitpläne für In-vitro-Diagnostika (IVD)
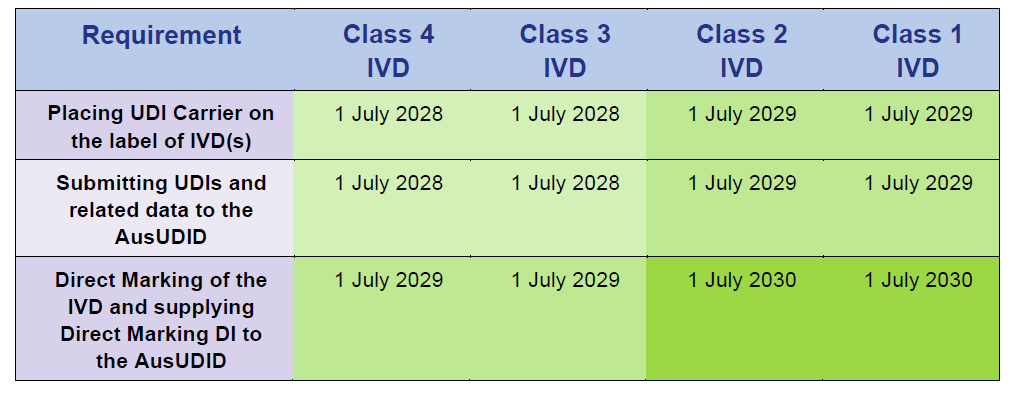
Quelle: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
Compliance-Anforderungen im Detail
Das australische UDI-System umfasst zwei Hauptphasen der Compliance:
Phase 1: Kennzeichnung und Datenübermittlung
- Anbringung des UDI-Trägers auf Geräteetiketten und relevanten Verpackungsebenen
- Übermittlung der UDI-DI (Device Identifier) und zugehöriger Daten an das AusUDID
- Verknüpfung der ARTG-ID mit den UDI-Datensätzen
- Aufnahme der UDI in Patienten-Implantat-Karten (bei implantierbaren Geräten)
- Integration der UDI in TGA-Meldungen (unerwünschte Ereignisse, Vorfälle, Marktmaßnahmen)
Phase 2: Direktmarkierung (falls zutreffend)
- Direktmarkierung wieder verwendbarer Geräte
- Übermittlung der Direktmarkierungs-Informationen an das AusUDID
- Aktualisierung bestehender UDI-Datensätze
Besondere Regelungen für bestehende Geräte
Ein wichtiger Aspekt der australischen UDI-Regelung betrifft bereits hergestellte Geräte:
Nur für Klasse III und IIb Medizinprodukte:
- Geräte, die vor dem 1. Juli 2026 hergestellt und etikettiert wurden
- Befinden sich am 1. Juli 2029 noch unter Sponsor-Kontrolle
- Müssen bis zu diesem Datum UDI-konform neu etikettiert werden
Ausnahmen:
- Bereits an Krankenhäuser, Distributoren oder Patienten gelieferte Geräte sind lebenslang von UDI-Anforderungen befreit
- Andere Geräteklassen (IIa, Is) sind von der Neukennzeichnungsanforderung ausgenommen
Refurbishment und Wiederaufarbeitung
Besondere Aufmerksamkeit verdienen wiederaufgearbeitete Geräte:
Wiederaufarbeitung durch anderen Hersteller:
- Gilt als neues Gerät mit allen UDI-Anforderungen
- Benötigt neue ARTG-Einbeziehung
- Muss UDI-Anforderungen zum relevanten Compliance-Termin erfüllen
Wiederaufarbeitung durch Originalhersteller:
- Kann unter bestehendem ARTG geliefert werden (bei unverändertem Verwendungszweck)
- Bei Zweckänderung: Gilt als neues Gerät
- Direktmarkierungsanforderungen gelten ohne Ausnahme
Sonderregelungen für EU-Zertifikate
Für Produkte, die unter EU MDD/IVDD-Zertifikaten in Australien vertrieben werden, gelten verlängerte Übergangsfristen, die mit der EU MDR/IVDR-Transition abgestimmt sind:
Medizinprodukte unter EU MDD-Zertifikaten:
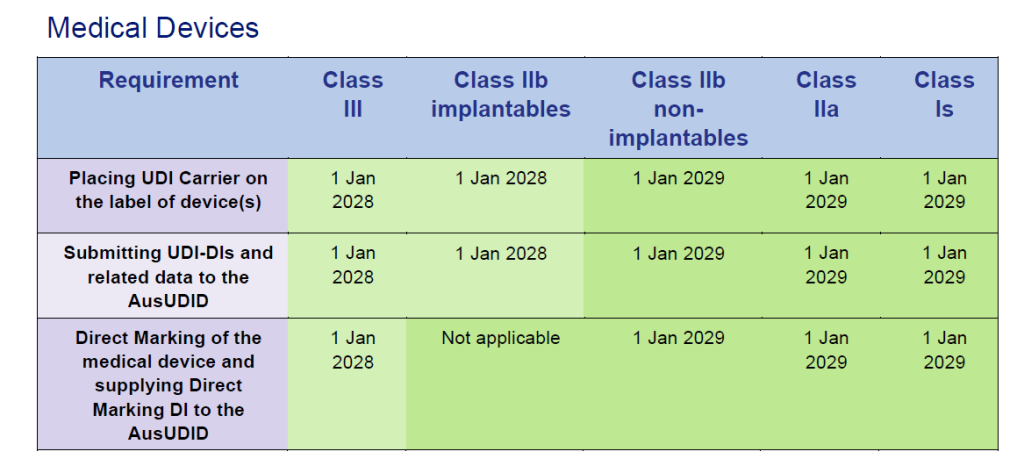
Quelle: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
IVD unter EU IVDD-Zertifikaten:
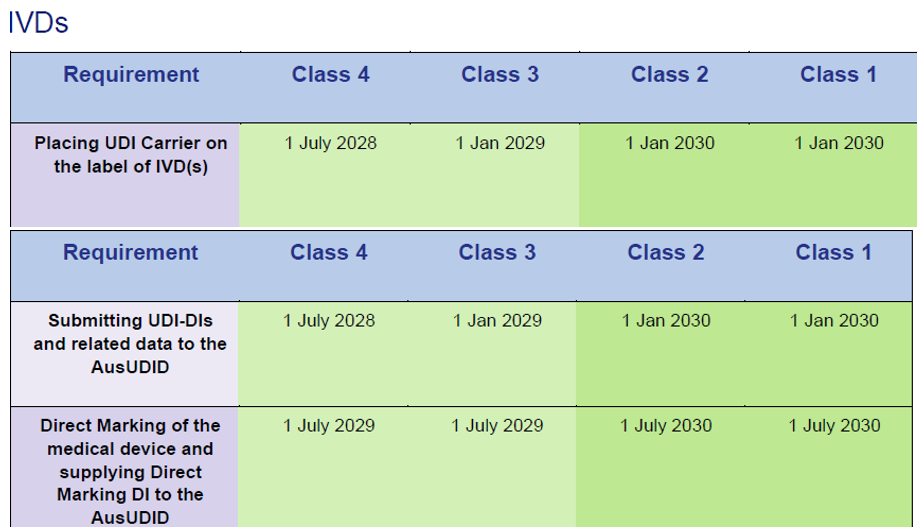
Quelle: Timeframes for supplying UDI compliant medical devices in Australia, Version 1.0 March 2025
Wichtig: Sobald Ihre Produkte auf EU MDR/IVDR-Zertifikate umgestellt werden, gelten die australischen Standard-Compliance-Termine!
Wichtige Hinweise
- Freiwillige Umsetzung ist bereits vor den verbindlichen Terminen möglich und wird empfohlen
- Bestehende Geräte: Klasse III und IIb Geräte müssen bis 1. Juli 2029 neu gekennzeichnet werden, falls noch unter Sponsor-Kontrolle
- Datenübermittlung: UDI-Daten müssen innerhalb von 30 Tagen nach Inverkehrbringen übermittelt werden
- Neue Anträge unter MDD: Nachweis der EU-Verlängerungsberechtigung erforderlich
Unsere Empfehlung
Beginnen Sie frühzeitig mit der Vorbereitung:
- Prüfen Sie Ihre Geräteklassifizierung
- Bereiten Sie UDI-Kennzeichnungen vor
- Testen Sie Ihre Datenübermittlungsmethoden
- Berücksichtigen Sie EU-Übergangsbestimmungen
Kontaktieren Sie uns für eine individuelle Beratung zu Ihren UDI-Anforderungen.
Praktische Schritte zur Vorbereitung
1. Bestandsaufnahme und Klassifizierung
- Vollständige Erfassung aller in Australien vertriebenen Produkte
- Bestätigung der Geräteklassifizierung
- Identifizierung der relevanten Compliance-Termine
- Prüfung bestehender EU-Zertifikate und deren Gültigkeitsdauer
2. Technische Vorbereitung
- Auswahl eines akkreditierten UDI-Anbieters (GS1, HIBCC, ICCBBA)
- Entwicklung der UDI-Kennzeichnungsstrategie
- Anpassung der Etikettierung und Verpackung
- Vorbereitung der Direktmarkierung (falls erforderlich)
3. Datenmanagement
- Aufbau der UDI-Datensätze mit allen erforderlichen Informationen
- Test der Datenübermittlungsmethoden (Online-Portal, Bulk-Upload, Machine-to-Machine)
- Integration in bestehende ERP- und Qualitätsmanagementsysteme
- Schulung der verantwortlichen Mitarbeiter
4. Regulatorische Compliance
- Verknüpfung mit ARTG-Einträgen
- Vorbereitung der Post-Market-Überwachungsprozesse
- Integration in Meldeverfahren für unerwünschte Ereignisse
- Dokumentation aller UDI-bezogenen Prozesse
Risiken bei Nicht-Compliance
Die TGA hat klare Konsequenzen bei Nicht-Einhaltung der UDI-Anforderungen angekündigt:
- Aussetzung oder Streichung von Geräten aus dem Australian Register of Therapeutic Goods (ARTG)
- Zivilrechtliche Strafen gemäß Teil 4-11, Division 1 des Therapeutic Goods Act
- Verwarnungen und Bußgelder
Ausnahmegenehmigungen (Consent to Supply) sind nur in außergewöhnlichen Umständen und für begrenzte Zeiträume möglich. Anträge müssen rechtzeitig vor dem Compliance-Termin eingereicht werden.
Freiwillige frühe Umsetzung
Die TGA empfiehlt ausdrücklich die freiwillige frühe Umsetzung der UDI-Anforderungen:
Vorteile:
- Reduzierung der Verwirrung bei Endnutzern (Gesundheitspersonal, Krankenhäuser, Patienten)
- Frühe Identifizierung und Behebung von Implementierungsproblemen
- Bessere Verteilung der Arbeitsbelastung
- Competitive Advantage durch frühe Compliance
Empfehlung: Bei freiwilliger Umsetzung sollten alle UDI-Anforderungen vollständig erfüllt werden, um Inkonsistenzen zu vermeiden.









Related Posts