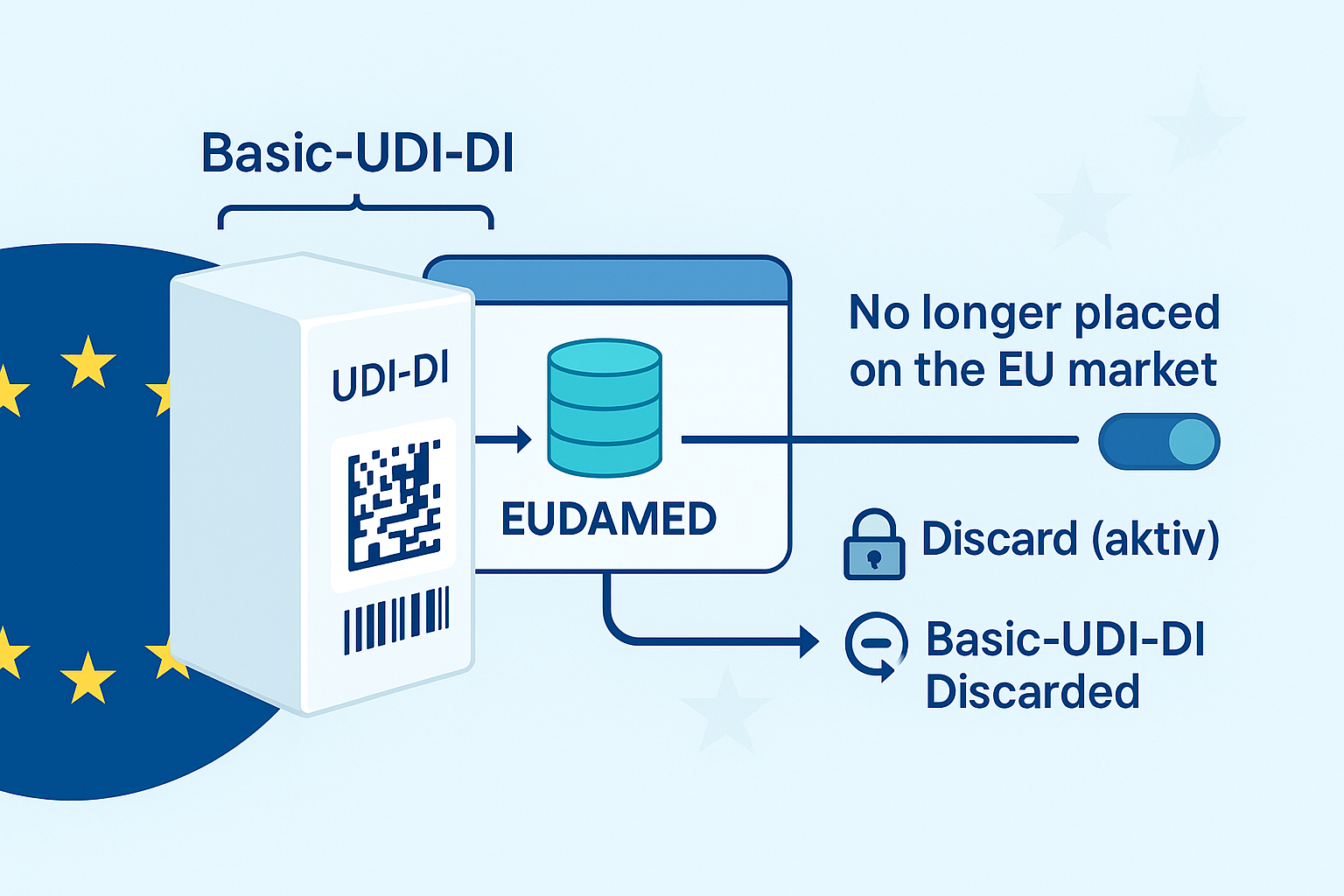
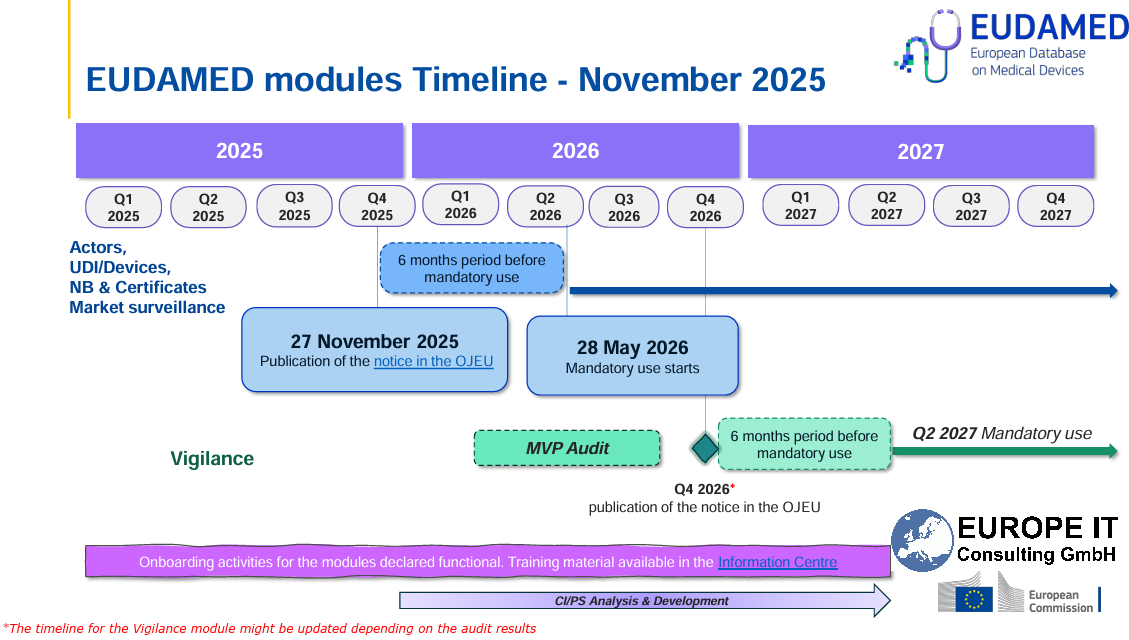
Mit Verabschiedung der neuen EU Medizinprodukteverordnung (Medical Device Regulation – MDR) durch das Europäische Parlament am 5. April 2017, tritt nun auch die Europäische UDI Regelung zur Kennzeichnung undRegistrierung von Medizinprodukten in Kraft. Gemäß dem Amtsblatt der Europäischen Union, ist die neue Medizinproduktverordnung, welche im Artikel 24 beschrieben ist, nach einer dreijährigen Übergangsfrist ab dem 25. April 2020 verpflichtend für alle Medizinprodukte Hersteller, die in Europa Ihre Produkte vertreiben. Unser UDI SAP Add-On wird zukünftig neben der Stammdatenverwaltung der FDA UDI Daten auch die Verwaltung der EUDAMED – Europäische UDI Daten – unterstützen.
Europäische UDI Regelung zur Kennzeichnung und Registrierung von Medizinprodukten
UDI Consultant
Ismail Demiralp is the Founder and Managing Director of Europe IT Consulting GmbH, based in Basel, Switzerland. He started his career as a software developer, building deep expertise in complex IT systems and regulatory-driven data architectures. Now he is building UDI solutions for MedTech companies.







Related Posts