Europe IT Consulting stellt das Global Submission Portal mit Fokus auf FDA eMDR vor
Neue Cloud-Plattform bündelt eMDR, GUDID und EUDAMED in einem System
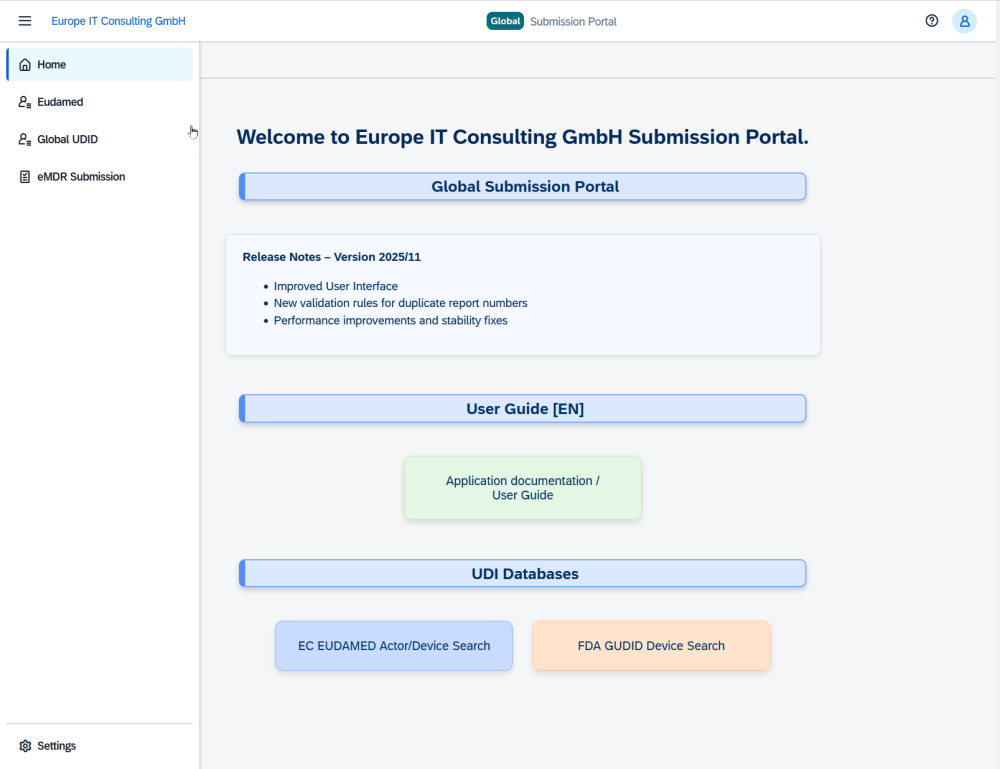
Mit dem Global Submission Portal bringt Europe IT Consulting eine Cloud-Plattform auf den Markt, die besonders den aufwendigen Prozess der FDA eMDR-Meldungen deutlich vereinfacht. Zusätzlich unterstützt die Lösung UDI für FDA GUDID und EUDAMED und dient damit als zentrale Plattform für weltweite Einreichungen bei ausgewählten Behörden.
Medizinproduktehersteller stehen vor der Herausforderung, Meldungen und UDI-Daten in unterschiedlichen Formaten und Portalen zu verwalten. Gerade im Vigilanz-Bereich ist der Zeitdruck hoch – und Fehler können direkte Auswirkungen auf Fristen und Compliance haben.
Warum FDA eMDR im Mittelpunkt steht
Die elektronische Meldung von Vorkommnissen an die FDA (Electronic Medical Device Reporting, eMDR) ist technisch anspruchsvoll: HL7 ICSR-Struktur, ESG Submission Gateway, mehrere ACK-Nachrichten und strenge Validierungen. Viele Unternehmen arbeiten hier noch mit manuellen Uploads und separaten Tools.
Europe IT Consulting adressiert genau diesen Pain Point: Das Global Submission Portal ist so aufgebaut, dass eMDR-Fälle strukturiert, automatisiert und nachverfolgbar verarbeitet werden können – ohne dass die Fachabteilungen HL7- oder XML-Know-how benötigen.
FDA eMDR als Kernmodul im Global Submission Portal
Das Modul FDA eMDR ist einer der drei zentralen Bausteine des Global Submission Portal:
-
Excel-basierte Fallaufnahme
Fachabteilungen erfassen alle relevanten Informationen (z. B. Adverse Event, Product Problem) in einem strukturierten Excel-Template, das an die FDA-Anforderungen angelehnt ist. -
Automatische Konvertierung & Übermittlung
Aus den Excel-Daten wird im Hintergrund eine valide HL7 ICSR XML-Datei erzeugt und über eine M2M-Verbindung über das ESG Submission Gateway an die FDA übertragen – ohne manuelles Handling im eSubmitter-Tool. -
ACK-Handling & Statusübersicht im Portal
Die von der FDA zurückgesendeten Bestätigungen (ACK-Nachrichten) werden automatisch verarbeitet und im Portal über gut nachvollziehbare Status dargestellt – von „Uploaded“ über „Processing“ bis „Success“ oder „Failed“. -
Validation Errors & Download-Center
Kommt es zu Validierungsfehlern, werden diese mit Details (z. B. Abschnitt, XPath, Meldung der Behörde) angezeigt. Ergebnisdateien und Behördenantworten – etwa FDA-ACKs – können gesammelt als ZIP oder einzeln heruntergeladen werden.
Damit wird das Global Submission Portal zur zentralen Oberfläche, über die Vigilanz- und Regulatory-Teams ihre eMDR-Meldungen von der Erfassung bis zur finalen Bestätigung steuern können.
Weitere Module: UDI Übertragung an FDA GUDID und EUDAMED
Neben eMDR deckt das Global Submission Portal zwei weitere wichtige Compliance-Bereiche ab:
-
FDA GUDID – Unterstützung bei der Übermittlung von UDI-Daten an die Global UDI Database für den US-Markt
-
EUDAMED – EU-MDR-konforme UDI-Einreichungen an die europäische Datenbank für Medizinprodukte
Auch hier kommen die gleichen Prinzipien zum Einsatz: Excel-basierter Upload, automatische Validierung und transparente Statusverfolgung der Einreichungen.
Mehr erfahren & Demo anfragen
Das Global Submission Portal ist ab sofort verfügbar.
Weitere Informationen finden Sie unter:
Produktseite: https://www.europe-it-consulting.ch/global-submission-portal/









Related Posts