
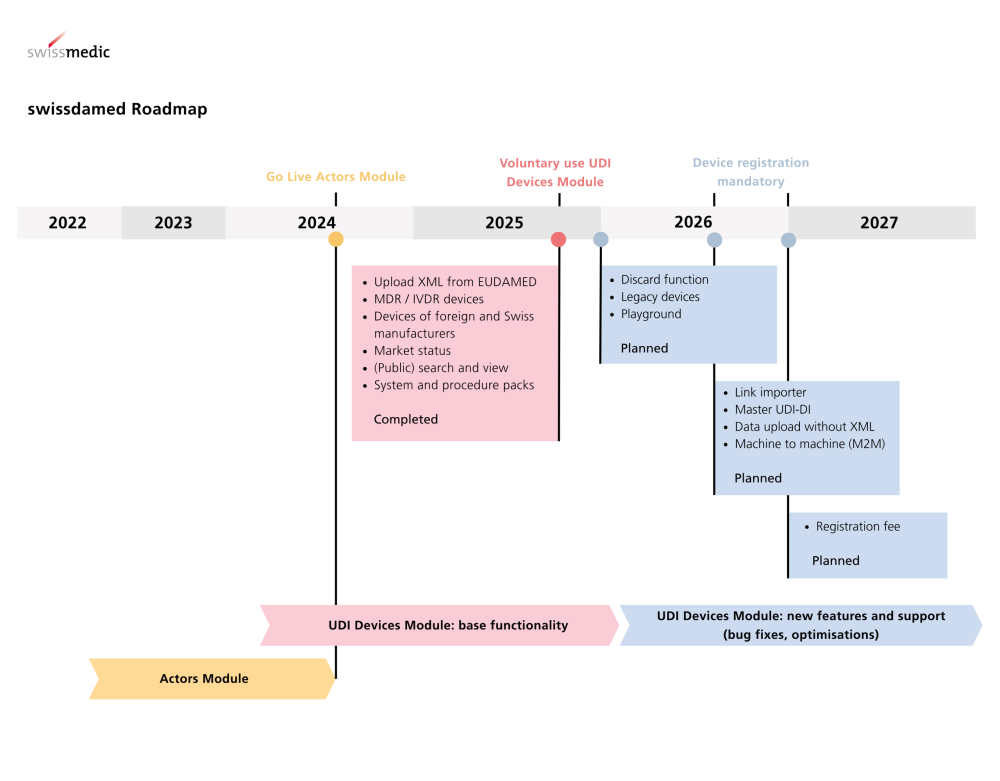
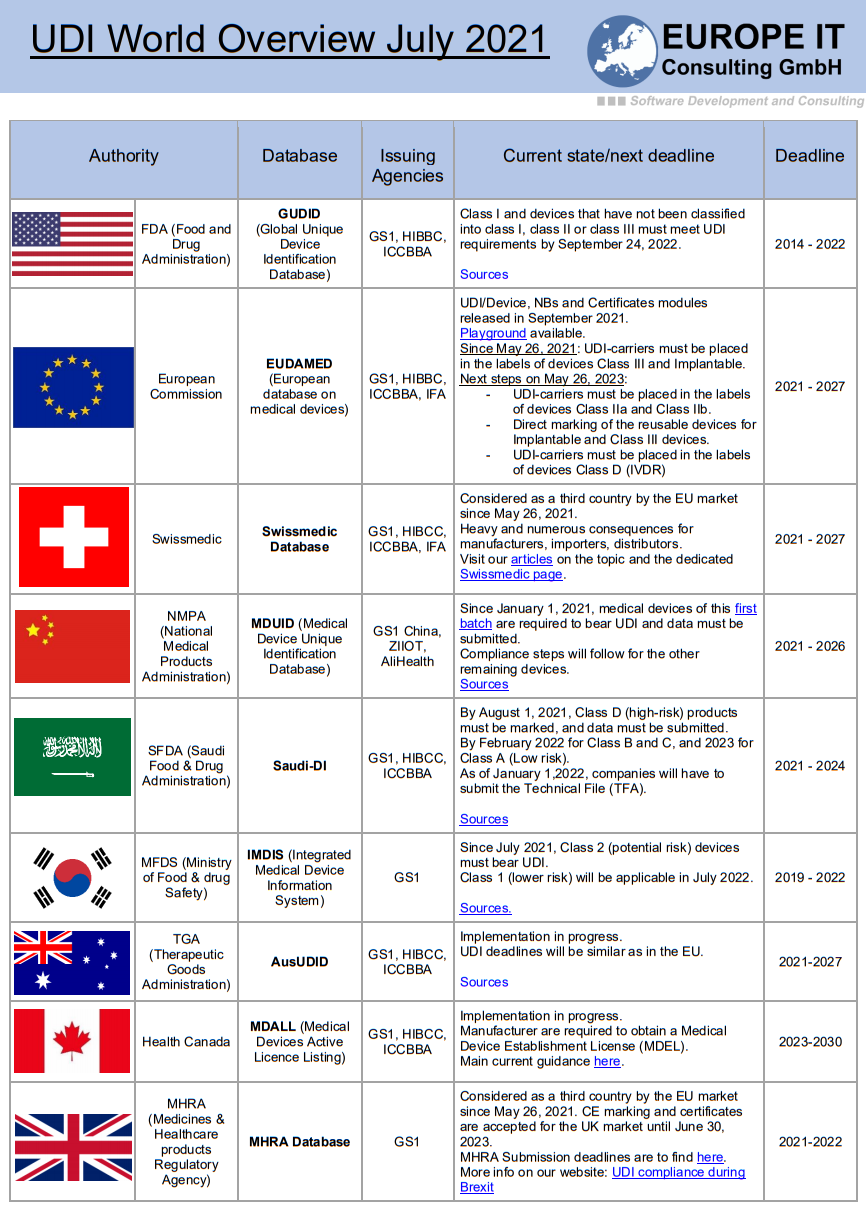
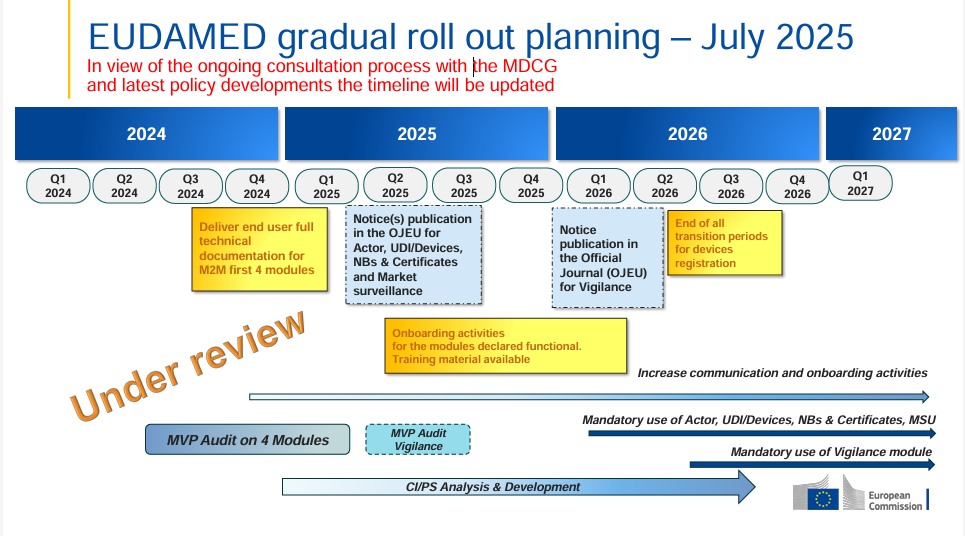
Aktuelle Informationen der TGA Australien
Die australische Therapeutic Goods Administration (TGA) hat bedeutende Fortschritte bei der Einführung des Unique Device Identification (UDI)-Systems für Medizinprodukte erzielt.
Sehr gerne möchten wir Sie über diese wichtigen Entwicklungen in Kenntnis setzen:
Veröffentlichung des Entwurfs der UDI-Leitlinie:
-
- Am 12. Dezember 2024 hat die TGA den Entwurf der Leitlinie „Complying with the Unique Device Identification regulations for medical devices“ zur externen Überprüfung veröffentlicht.
- Diese Leitlinie soll Sponsoren und Herstellern helfen, ihre regulatorischen Verpflichtungen gemäß dem Therapeutic Goods Act zu verstehen.
- Download der Leitlinie.
Aktualisierungen der Australian UDI Database (AusUDID):
-
- Am 27. November 2024 wurden bedeutende Verbesserungen in der Pre-Production-Umgebung der AusUDID implementiert.
- Diese beinhalten Änderungen zur Unterstützung mehrerer Sponsoren für dasselbe Medizinprodukt, Anpassungen der Datenbankstruktur und Fehlerbehebungen.
- Die aktualisierte Bulk-Upload-Vorlage (Version 2.3) steht nun im AusUDID-Portal zur Verfügung.
- Download der aktualisierten Bulk-Upload-Vorlage (Version 2.3).
Konsultation zur Mehrfachsponsorenschaft:
-
- Die TGA hat Konsultationen durchgeführt, um die Möglichkeit zu prüfen, dass mehrere Sponsoren dasselbe Medizinprodukt in der AusUDID registrieren können.
- Dies soll die Flexibilität und Genauigkeit der Datenbank erhöhen.
Auswirkungen für Sponsoren und Hersteller
Sponsoren und Hersteller werden ermutigt, den Entwurf der UDI-Leitlinie zu überprüfen und Feedback zu geben. Die Pre-Production-Umgebung der AusUDID ist nun für Tests und Rückmeldungen geöffnet. Es ist wichtig, die aktualisierte Bulk-Upload-Vorlage zu verwenden und sich auf die bevorstehenden Änderungen vorzubereiten, um die Einhaltung der neuen UDI-Vorschriften sicherzustellen.






Related Posts