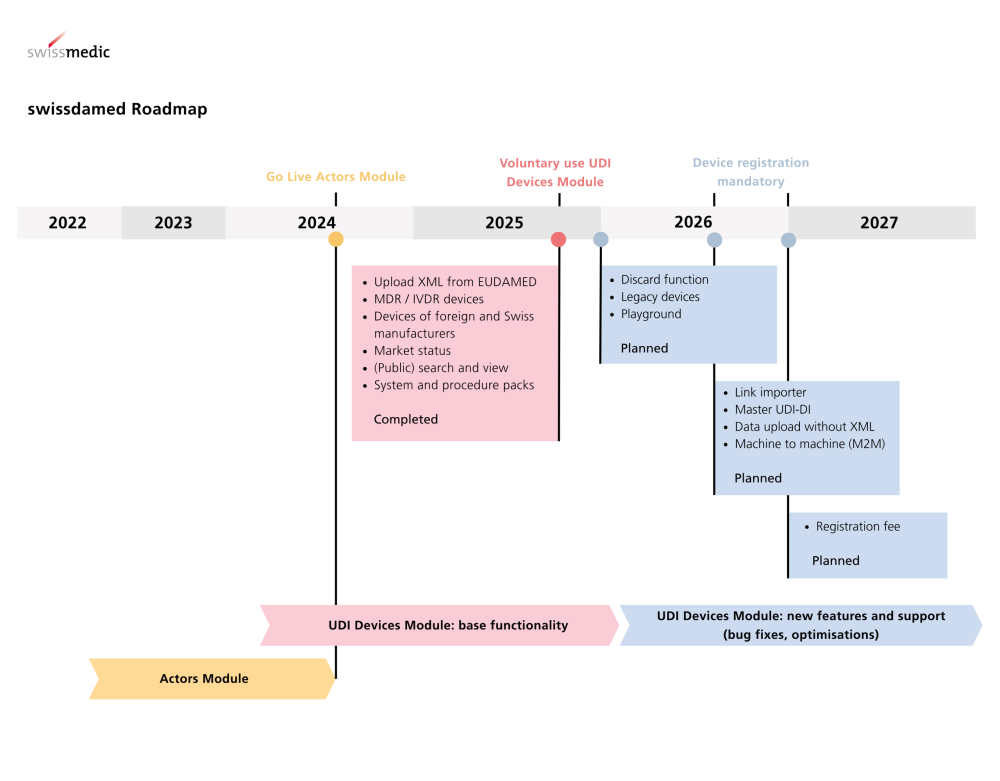
UDI-Devices-Modul live
Swissmedic erweitert die nationale Medizinprodukte-Datenbank um eine zentrale Funktionalität.
Das UDI-Devices-Modul in swissdamed ist seit dem 18. August 2025 live. Ab sofort können Medizinprodukte, In-vitro-Diagnostika sowie Systeme und Verfahrenspacks registriert werden. Die Registrierung ist zunächst freiwillig, wird aber ab 1. Juli 2026 verpflichtend; für die meisten Produkte gilt eine Übergangsfrist bis Ende 2026.
Für Produkte mit Meldepflicht (schwere Vorkommnisse, FSCA, Trends) gibt es keine Übergangsfrist – hier greift die Registrierungspflicht ab 1. Juli 2026.
Kurzfassung
-
Neu: UDI-Devices-Modul ermöglicht die Produktregistrierung in swissdamed.
-
Pflicht: Registrierung ab 01.07.2026, i. d. R. mit Übergangsfrist bis 31.12.2026.
-
Keine Übergangsfrist: Für meldepflichtige Produkte (schwere Vorkommnisse, FSCA, Trends).
-
Hintergrund: swissdamed wird seit August 2024 betrieben; Actors-Modul ist seit Start aktiv.
Was ist neu?
Das neue Modul ergänzt swissdamed um die Registrierung und Verwaltung von Medizinprodukten, IVDs sowie Systemen/Verfahrenspacks – ein signifikanter Transparenzgewinn für den Schweizer Markt.
Wichtige Termine & Übergangsregelungen
-
Ab sofort: Registrierung freiwillig möglich.
-
Ab 1. Juli 2026: Registrierung verpflichtend für in der Schweiz in Verkehr gebrachte Produkte. Übergangsfrist bis 31. Dezember 2026.
-
Keine Übergangsfrist für Produkte mit Meldepflicht (schwere Vorkommnisse, FSCA, Trends) – Pflicht ab 1. Juli 2026.
Betroffene Wirtschaftsakteure
Registrierungspflichten treffen u. a. Schweizer Hersteller, Bevollmächtigte und Zusammensteller von System-/Procedurepacks.
Bedeutung für den Markt
Mit der Produktregistrierung wächst die Markttransparenz; die schrittweise Roll-out-Strategie erlaubt es Akteuren, Prozesse rechtzeitig aufzusetzen (Actors-Modul seit 08/2024, jetzt UDI-Devices).
Was Sie jetzt tun solten? (praktisch)
-
Akteursdaten checken: Actors-Modul vollständig & aktuell halten (CHRN, Nutzerrechte, Mandate).
-
Portfolio priorisieren: Alle in CH in Verkehr gebrachten Produkte/IVDs/Systeme identifizieren; meldepflichtige Produkte zuerst einplanen.
-
Datenqualität sichern: UDI-Stammdaten, Verantwortlichkeiten, Änderungsprozesse und Evidenzen (z. B. FSCA/Trend-Bezüge) definieren.
-
Technisch vorbereiten: Entscheiden zwischen XML-Upload (heute der Weg) und späteren Skalierungsoptionen (Vorlagen/Automatisierung).
-
Zeitplan fixen: Interne Meilensteine bis 01.07.2026 (Pilot-Uploads, Reviews, Freigaben).
Weitere Informationen
Alle Details zu Pflichten, Zeitplänen, technischen Grundlagen und weiteren Funktionalitäten finden Sie in der Swissmedic-Dokumentation; swissdamed ist hier erreichbar: swissdamed.ch.
Nutzen Sie unsere Erfahrung für Ihren erfolgreichen Start in swissdamed.







Related Posts