Die smarte Lösung für konforme UDI-Datenverwaltung
Verwandeln Sie regulatorische Herausforderungen in Wettbewerbsvorteile
Ihr Problem ist unsere Lösung
In einer Zeit zunehmender regulatorischer Anforderungen stehen Medizinproduktehersteller vor einer entscheidenden Herausforderung: Wie können Sie die komplexen EUDAMED-Anforderungen effizient erfüllen, ohne wertvolle Ressourcen zu verschwenden?
Unsere Excel-Vorlage bietet den ersten Schritt – entwickelt von UDI-Experten für Unternehmen, die Wert auf Effizienz und 100% Compliance legen.
Bitte füllen Sie das Formular aus für ein Angebot
Einen Blick in unsere leistungsstarke Excel-Vorlage /
Praktische Demonstration: So einfach ist die Arbeit mit unserer Excel-Vorlage
Die EUDAMED MDR/IVDR Excel-Vorlage auf einen Blick:
Umfassende Register für alle erforderlichen UDI-Daten:
- Basic UDI-DI Registerkarte:
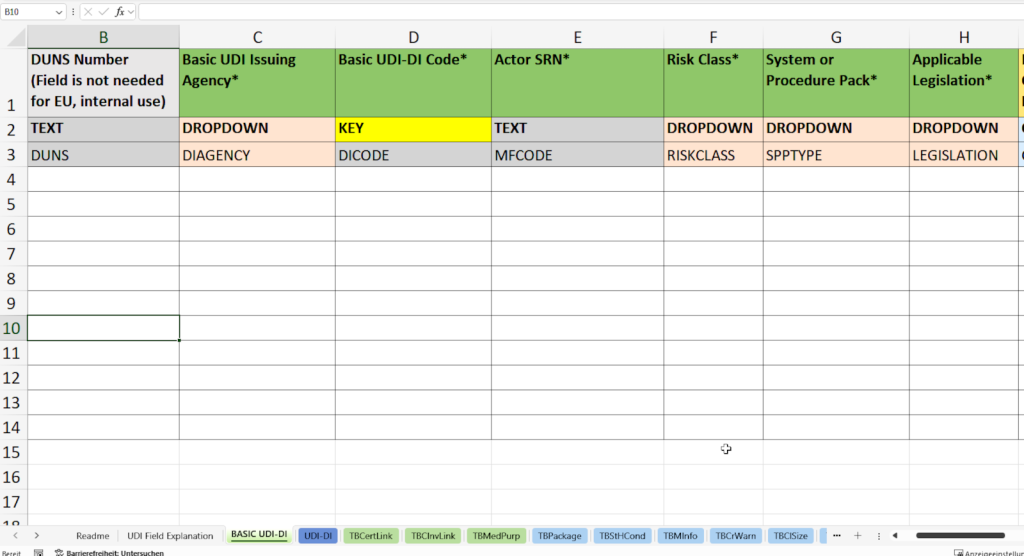 In dieser Registerkarte erfassen Sie alle notwendigen Stammdaten für die eindeutige Identifikation Ihrer Produktfamilie gemäß den Vorgaben der EUDAMED-Datenbank (European Database on Medical Devices).
In dieser Registerkarte erfassen Sie alle notwendigen Stammdaten für die eindeutige Identifikation Ihrer Produktfamilie gemäß den Vorgaben der EUDAMED-Datenbank (European Database on Medical Devices).
- Vergabe und Dokumentation der Basic UDI-DI (Basic UDI-DI Code) nach den Spezifikationen der zuständigen Vergabestelle (Basic UDI Issuing Agency), z. B. GS1, HIBCC oder ICCBBA.
- Erfassung der SRN (Single Registration Number, Actor SRN) Ihres Unternehmens oder des EU-Bevollmächtigten (Authorized Representative SRN).
- Zuweisung der Risikoklasse (Risk Class) wie Klasse I, IIa, IIb oder III entsprechend der MDR/IVDR-Vorgaben.
- Auswahl des Produkttyps (System or Procedure Pack)
- Festlegung der anwendbaren Gesetzgebung (Applicable Legislation) – Medizinprodukteverordnung (MDR) oder In-vitro-Diagnostika-Verordnung (IVDR).
- Angabe von IVDR-spezifischen Eigenschaften, wie: Begleitdiagnostikum (Companion Diagnostic); Nachweis mikrobiologischer Substanzen oder Zellen (Presence of cells/substances of microbial origin); Nahe-an-Patienten-Testung (Near-patient testing); Selbsttestung (Self-patient testing); Verwendung als Instrument (Instrument), Kit (Kit) oder für professionelle Tests (Professional testing)
- Kennzeichnung als aktives Gerät (Active device), mit Messfunktion (Measuring function) oder Verabreichungsfunktion (Administer device).
- Angabe, ob es sich um ein wiederverwendbares chirurgisches Instrument (Reusable surgical instrument) oder ein implantierbares Produkt (Implantable device) handelt.
- Spezifikation besonderer Gerätetypen (Special Device Type)
- Erfassung des Gerätemodells (Device Model) und/oder Gerätenamens (Device Name).
- Angabe zur Verwendung tierischer (Presence of animal tissues or cells) oder menschlicher Bestandteile (Presence of human tissues or cells).
Bitte füllen Sie das Formular aus für ein Angebot
- UDI-DI Registerkarte:
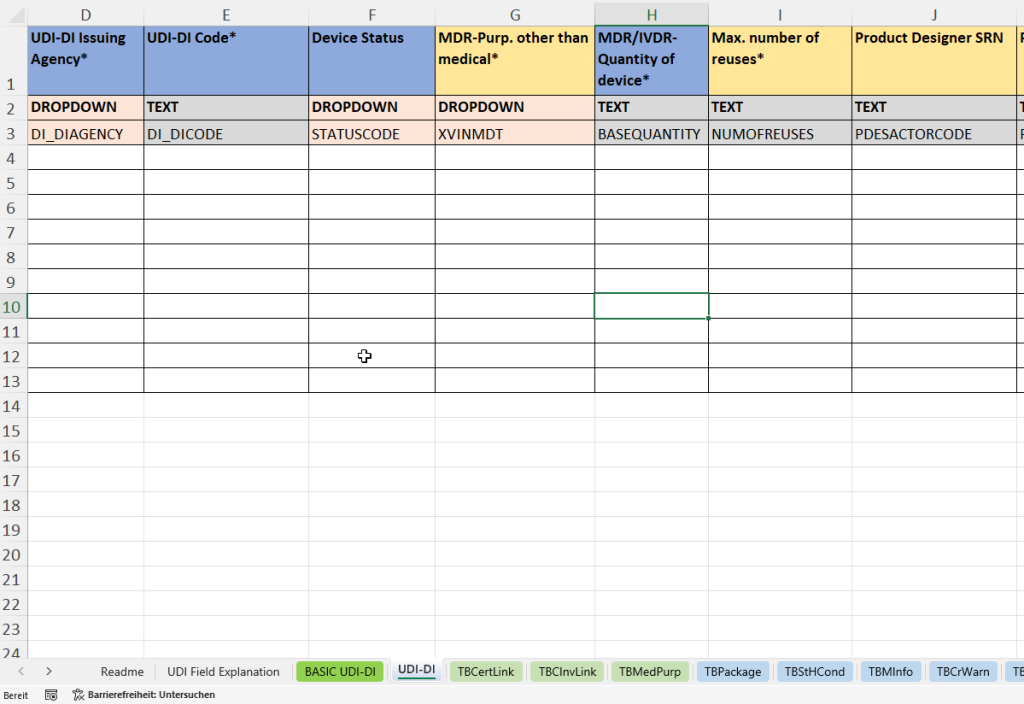 In dieser Registerkarte werden alle produktbezogenen Einzeldaten erfasst, die für die eindeutige Identifikation und Rückverfolgbarkeit eines spezifischen Medizinprodukts erforderlich sind. Die UDI-DI (Unique Device Identification – Device Identifier) stellt den primären Schlüssel für die Produktregistrierung in EUDAMED dar.
In dieser Registerkarte werden alle produktbezogenen Einzeldaten erfasst, die für die eindeutige Identifikation und Rückverfolgbarkeit eines spezifischen Medizinprodukts erforderlich sind. Die UDI-DI (Unique Device Identification – Device Identifier) stellt den primären Schlüssel für die Produktregistrierung in EUDAMED dar.
- Verknüpfung mit der übergeordneten Basic UDI-DI (Parent Basic UDI DI Code) zur Einordnung in eine Produktfamilie.
- Erfassung der Materialnummer (Material) und Materialbeschreibung (Material Text) zur internen Referenz.
- Vergabe der UDI-DI durch eine akkreditierte Agentur (UDI-DI Issuing Agency) und Eintragung des eindeutigen Codes (UDI-DI Code).
- Festlegung des Gerätestatus (Device Status)
- Angabe des Verwendungszwecks außerhalb der Medizin (MDR Purpose other than medical)
- Erfassung der Stückzahl pro Verkaufseinheit (Quantity of device) und der maximalen Wiederverwendbarkeit (Max. number of reuses).
- Angabe des Produktentwicklers (Product Designer SRN und Product Designer ID).
- Eindeutige Referenznummer (Reference Number) zur Identifikation in Unterlagen und Verpackung.
- Direkte Markierung am Produkt (Direct Marking) sowie Angaben zu: gleiche DI für direkte Markierung wie für UDI-DI (DM DI same as UDI-DI Code); Austellende Agentur der direkten Markierung (DM Issuing Agency); Direktmarkierungs-Code (DM DI Code)
- Sterilkennzeichnung (Device labelled as sterile) und Sterilisationspflicht vor Gebrauch (Device needs sterilization before use)
- Angabe, ob es sich um ein neues Produkt handelt (New Device) gemäß IVDR
- Enthält Latex (Containing latex)
- Wiederaufbereitetes Einmalprodukt (Reprocessed single-use device)
- Als Einmalprodukt gekennzeichnet (Labelled as single use)
- Produktionsidentifikation (Production Identifier – PI): Los- oder Chargennummer (Lot or Batch number); Ablaufdatum (Expiration Date); Herstellungsdatum (Manufacturing Date); Seriennummer (Serial Number) und die Softwareversion (Software Identification)
- Zusätzliche Identifikatoren: Zweite UDI-Vergabestelle (Secondary Issuing Agency) und sekundärer UDI-DI-Code (Secondary UDI-DI Code) und UDI für Einzelverpackungen (Unit of Use DI Code) und zugehörige Ausgabestelle (Unit of Use Issuing Agency)
- Weiterführende Informationen: URL zur digitalen Gebrauchsanweisung (URL for additional information / eIFU)
- Zertifikatsinformationen:
- Erfassung des zugehörigen Basic UDI-DI-Codes (Basic UDI Code) zur eindeutigen Verknüpfung mit dem Zertifikat.
- Eintrag der Zertifikatsnummer (Certificate No.) gemäß Benannter Stelle (NB). und Verwaltung der Revisionsnummer (Certificate Revision No. – Cert. rev. no.), z. B. bei Verlängerung oder Änderung.
- Auswahl des Zertifikatstyps (Certificate Type – Cert. type) aus einer vordefinierten Liste (z. B. EU-Konformitätsbescheinigung, QMS-Zertifikat) und Eintrag des Codes der benannten Stelle (NB Code – Notified Body Code), sowie Angabe des Ablaufdatums (Expiry Date) des Zertifikats, falls es sich um ein Produkt unter MDD, IVDD oder AIMDD handelt.
- Klinsche Prüfung (Clinical Investigation)
- Eintragung der Kennung der klinischen Prüfung (Clinical Investigation ID) gemäß Studienprotokoll oder Datenbankeintrag.
- Angabe des Landes (Country), in dem die klinische Prüfung durchgeführt wurde
- Sprach- & Zweck (Language & Medical Purpose)
- Auswahl der Sprache (Language), in der produktbezogene Informationen bereitgestellt werden (z. B. Etikett, Gebrauchsanweisung, EUDAMED-Daten).
- Angabe des medizinischen Verwendungszwecks (Indication of medical purpose)
- Verpackungsinformationen (Packaging Hierarchy):
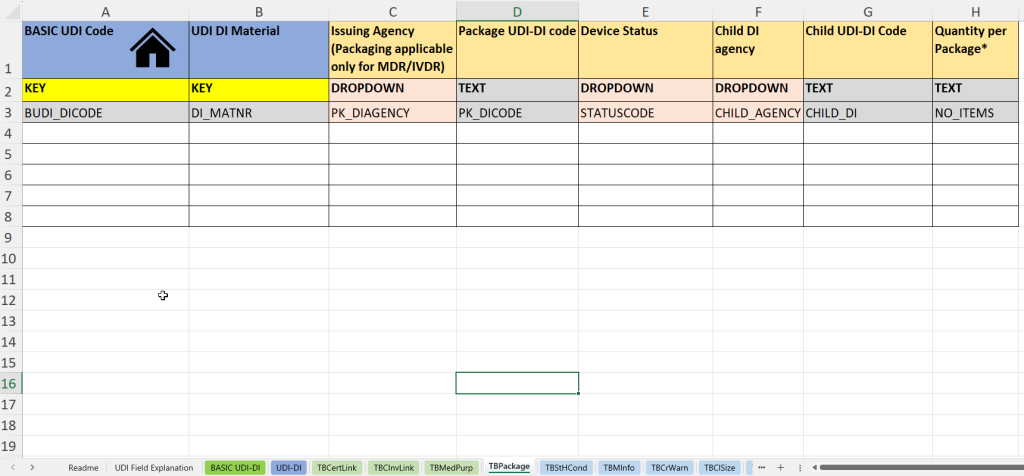 In dieser Registerkarte werden Informationen zu Verpackungseinheiten sowie zu untergeordneten UDI-DI-Strukturen („Child UDI“) dokumentiert – besonders relevant für mehrstufige Verpackungen oder Sets.
In dieser Registerkarte werden Informationen zu Verpackungseinheiten sowie zu untergeordneten UDI-DI-Strukturen („Child UDI“) dokumentiert – besonders relevant für mehrstufige Verpackungen oder Sets.
- UDI-DI Materialnummer (UDI DI Material) zur internen Identifikation der Verpackungseinheit.
- Vergabestelle für die Verpackungs-UDI-DI (Issuing Agency – Packaging)
- Eintragung des UDI-DI-Codes der Verpackung (Package UDI-DI Code) – z. B. für Umverpackungen oder Kits.
- Status des Produkts oder der Verpackung (Device Status) – z. B. aktiv/inaktiv.
- Angabe der Child UDI-Vergabestelle (Child DI Agency), falls es sich um untergeordnete UDI-DIs handelt.
- Child UDI-DI Code: UDI-Code des untergeordneten Produkts innerhalb der Verpackungseinheit.
- Stückzahl pro Verpackung (Quantity per Package) – wichtig für Sets, Blister oder Mehrfachverpackungen.
- Lagerungs- & Handhabungsbedingungen (Storage & Handling Conditions):
-
UDI-DI Materialnummer (UDI DI Material) zur Identifikation der betreffenden Einheit.
-
Angabe der Lagerungs- und Handhabungsbedingungen (Storage & Handling Conditions Type).
-
Sprache (Language) für die Beschreibung und ergänzende Beschreibung (Description) zur genaueren Erläuterung besonderer Lageranforderungen oder Hinweise.
-
Bitte füllen Sie das Formular aus für ein Angebot
- Marktinformationen (Marketinformation):
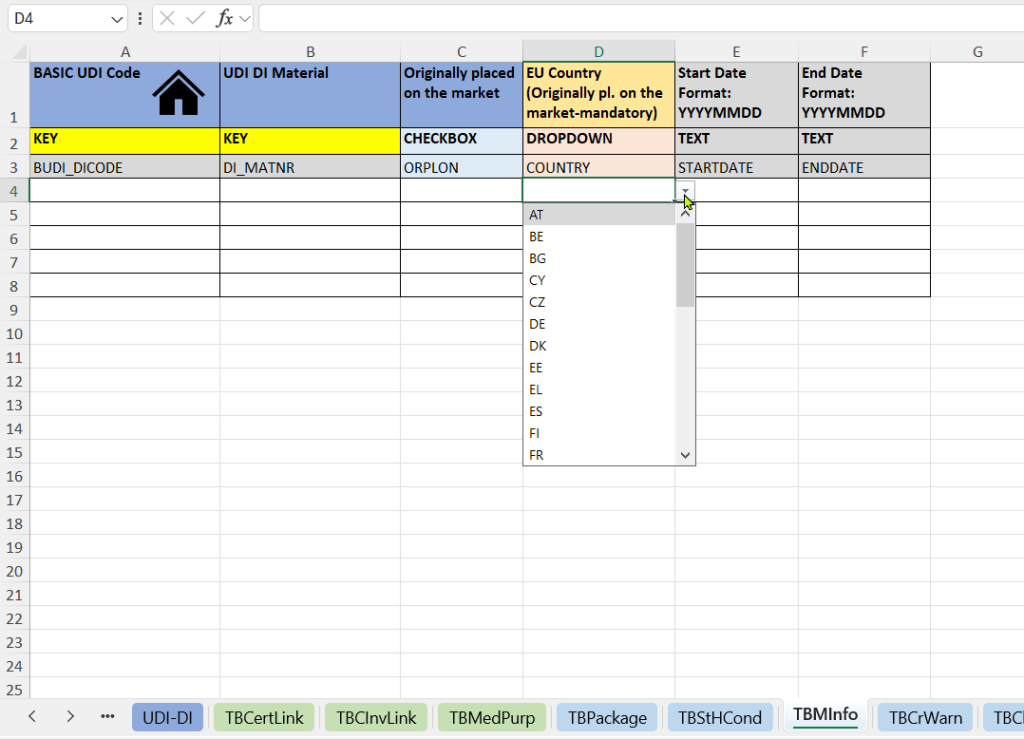 Diese Registerkarte dokumentiert, wann und wo ein Produkt erstmals in Verkehr gebracht wurde. Sie liefert regulatorisch relevante Nachweise für MDR-/IVDR-konforme Produkte und Legacy-Produkte.
Diese Registerkarte dokumentiert, wann und wo ein Produkt erstmals in Verkehr gebracht wurde. Sie liefert regulatorisch relevante Nachweise für MDR-/IVDR-konforme Produkte und Legacy-Produkte.
- Angabe, ob das Produkt ursprünglich in Verkehr gebracht wurde (Originally placed on the market).
- EU-Land der ursprünglichen Markteinführung (EU Country – Originally placed on the market).
- Markteinführungsdatum (Start Date and End Date).
- Kritische Warnhinweise (Critical Warning)
- Auswahl des Warnhinweistypen (Critical Warning Type) – z. B. Implantat, Latex, Radioaktivität, etc.
- Größenangaben (Size Information)
- Angabe des Größenformats (Size Type) – z. B. numerisch, alphanumerisch, symbolisc
- Genauigkeit/Präzision der Größenangabe (Precision)
- Größeneinheit (Size Unit)
- Wert oder Minimalwert (Value / Min. value) und Maximalwert (Max Value)
- Menschliche medizinische Substanzen (Medical Human Substance Tab)
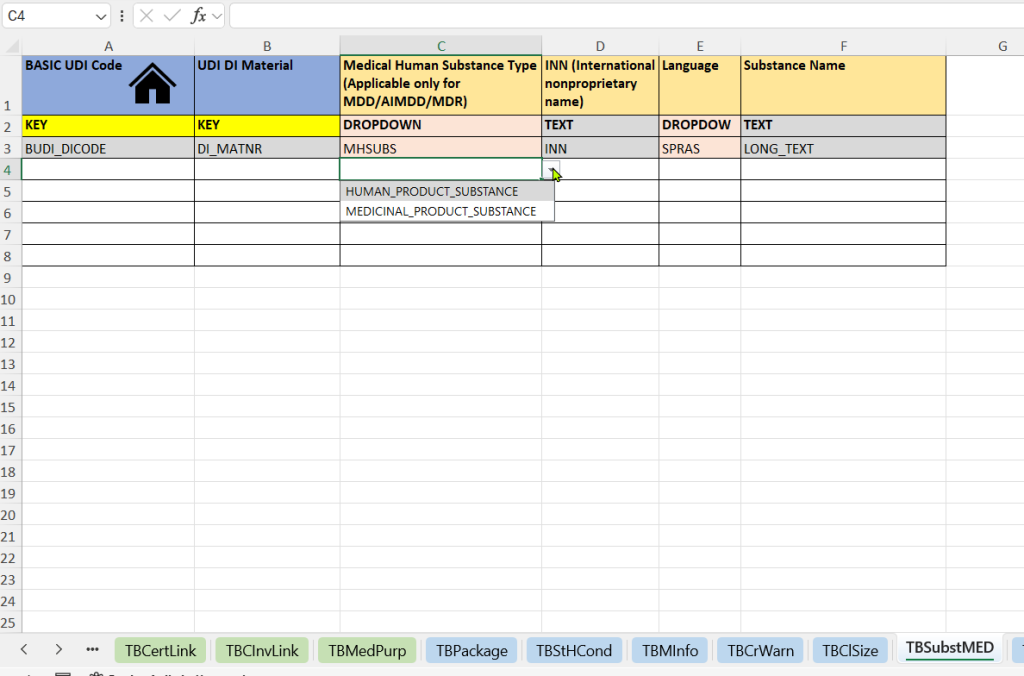
-
Auswahl des Substanztyps (Medical Human Substance Type)
-
Eintragung des internationalen Freinamens (INN – International Nonproprietary Name)
-
Angabe der Sprache (Language) – für die sprachspezifische Darstellung der Substanzangabe
-
Freitextliche Bezeichnung der Substanz (Substance Name) – zusätzliche Beschreibung oder national gebräuchlicher Name
-
- CMR-/endokrine Substanzen (CMR Endocrine Substances)
-
Auswahl des Substanztyps (CMR Endocrine Substances) – z. B. CMR-Kategorie 1A/1B, endokrine Disruptoren (Feld: CMRENDSUBS).
-
Angabe des CAS-Codes (CAS Code) – Chemical Abstracts Service Identifier (Feld: CASCODE).
-
Angabe des EG-/EINECS-/EC-Codes (EC Code) – Europäischer Stoffkennzeichner (Feld: ECCODE).
-
Sprache (Language) – für lokalisierte Beschreibungen, sofern erforderlich (Feld: SPRAS).
-
Freitextliche Bezeichnung der Substanz (Substance Name) – z. B. handelsüblicher Name oder spezifische Beschreibung (Feld: LONG_TEXT).
-
- Zusätzliche Produktbeschreibung (Additional Product Description)
-
Auswahl der Sprache (Language), in der die zusätzliche Beschreibung erfolgen soll (Feld: SPRAS).
-
Erfassung der zusätzlichen Produktbeschreibung (Additional Product Description)
(Feld: DESCR – z. B. zur Erläuterung der Funktion, Zusammensetzung oder Besonderheit des Sets)
-
- Handelsname (Trade Name Tab)
-
Auswahl der Sprache (Language) für den Handelsnamen (Feld: SPRAS).
-
Eintragung des Handelsnamens (Trade Name)
(Pflichtfeld – Feld: TRD_NAME, z. B. „CardioFlow Stent“, „MediCheck Rapid Test Kit“)
-
- Nomenklaturcode (EMDN Nomenclature)
- Auswahl des passenden EMDN-Codes (Nomenclature Code – EMDN) aus der offiziellen EUDAMED-Datenbank.
Bitte füllen Sie das Formular aus für ein Angebot
Intelligente Funktionen für maximale Effizienz:
- Farbliche Hervorhebung von Pflichtfeldern:

- Sofortige visuelle Identifikation obligatorischer Eingaben
- Unterscheidung zwischen bedingten und absoluten Pflichtfeldern
- Kontextbezogene Anzeige relevanter Felder basierend auf vorherigen Eingaben
- Validierte Drop-Down-Menüs:
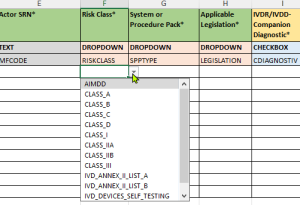
- Vordefinierte Auswahlmöglichkeiten entsprechend den EUDAMED-Anforderungen
- Aktualisierte Wertelisten gemäß den neuesten EU-Kommissionsvorgaben
- Reduzierung von Eingabefehlern durch standardisierte Optionen
- Automatische Abhängigkeitsprüfungen:
- Dynamische Anpassung der Eingabefelder basierend auf Produkttyp und Klassifizierung
- Logische Überprüfung der Datenkonsistenz zwischen verschiedenen Registerkarteien
- Warnhinweise bei potentiellen Unstimmigkeiten in der Dateneingabe
- Zweisprachige Unterstützung:
- Parallele Beschreibungen in Deutsch und Englisch
- Internationale Nutzbarkeit für globale Teams
- Konsistente Terminologie entsprechend der offiziellen EUDAMED-Dokumentation
- Dokumentationshilfen:
- Integrierte Erläuterungen zu komplexen Feldern
- Hinweise zu regulatorischen Anforderungen
- Tipps zur optimalen Dateneingabe
Umfassendes Leistungsangebot für Ihre EUDAMED-Compliance
- EUDAMED MDR/IVDR Excel-Vorlage: die professionelle Basis für Ihre strukturierte UDI-Datenverwaltung mit allen oben beschriebenen Funktionen.
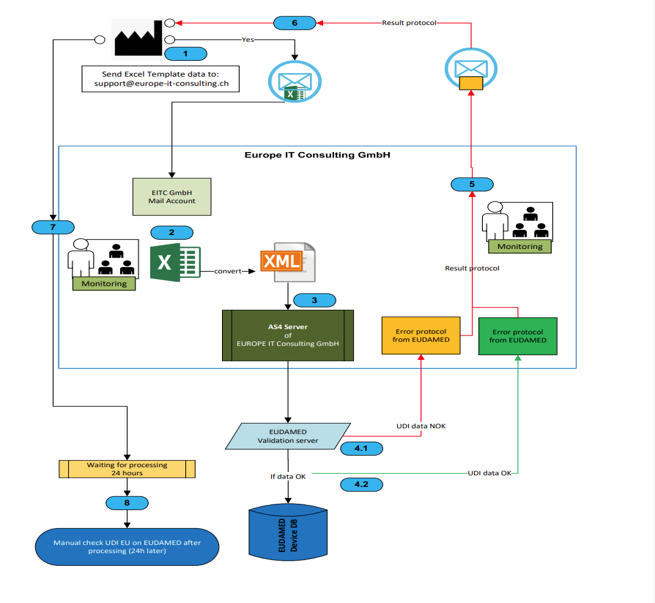
- XML-Konvertierungsservice: Wichtig: Die Umwandlung der Excel-Daten in das von EUDAMED benötigte XML-Format erfolgt nicht automatisch innerhalb der Vorlage. Unsere Experten übernehmen diese komplexe Aufgabe für Sie als separate Dienstleistung!
- EUDAMED-Übertragungsservice: Wir kümmern uns um den gesamten Prozess der Datenübermittlung an die EUDAMED-Datenbank – sicher, schnell und zuverlässig.
Technische Spezifikationen der Excel-Vorlage
- Dateiformat: Microsoft Excel (.xlsx)
- Kompatibilität: Microsoft Excel 2016 und höher
- Größe: Optimiert für schnelle Ladezeiten, auch bei umfangreichen Datensätzen
- Sicherheit: Passwortgeschützte Strukturen zur Vermeidung unbeabsichtigter Änderungen
- Updates: Regelmäßige Aktualisierungen entsprechend den neuesten EUDAMED-Anforderungen
- Sprachen: Deutsch und Englisch
- Datenvalidierung: Integrierte Prüfroutinen für konsistente Eingaben
Bitte füllen Sie das Formular aus für ein Angebot
Warum führende Medizintechnikunternehmen auf unsere Lösung vertrauen
Die Europe IT Consulting GmbH ist nicht nur ISO 9001-zertifiziert und SAP-Partner – wir sind Ihr strategischer Partner für die digitale Transformation Ihrer regulatorischen Prozesse.
Das macht unsere Excel-Vorlage einzigartig:
- Präzise Strukturierung nach EUDAMED-Anforderungen für Basic UDI-DI und UDI-DI Attribute
- Intelligente Drop-Down-Menüs mit validierten Auswahlmöglichkeiten
- Visuelle Hervorhebung von Pflichtfeldern und abhängigen Feldern
- Intuitive Navigation durch die komplexe Welt der UDI-Daten
- Mehrsprachige Unterstützung für internationale Teams (DE/EN)
- Optimale Vorbereitung für die weitere Verarbeitung durch unsere Experten
- ANALYSIEREN: Erkennen Sie den Wert unserer Gesamtlösung für Ihre spezifischen Herausforderungen. „Der erste Schritt zur Compliance-Optimierung“
- ERWERBEN: Sichern Sie sich unkompliziert Zugang zu unserer Excel-Vorlage über Digistore24. „Der Grundstein Ihrer regulatorischen Strategie“
- IMPLEMENTIEREN: Erfassen Sie Ihre Produktdaten in der benutzerfreundlichen Vorlagenstruktur. „Schluss mit komplizierter UDI-Dateneingabe“
- PROFITIEREN: Beauftragen Sie uns mit der XML-Konvertierung und EUDAMED-Übertragung – und genießen Sie einen vollständig abgesicherten EUDAMED-Workflow. „Konzentrieren Sie sich auf Ihr Kerngeschäft, während wir die technische Umsetzung übernehmen“
Perfekt abgestimmt auf Ihre individuellen Anforderungen
Für kleine und mittlere Produktportfolios:
Die Excel-Vorlage ist die ideale Basis für die Datenerfassung bei bis zu 20 Datensätzen – ergänzt durch unseren Konvertierungs- und Übertragungsservice.
Für umfangreiche Produktlinien:
Die perfekte Grundlage für M2M-Integrationen bei größeren Datenmengen (über 20 UDI-DI Einträge) – mit zusätzlicher Unterstützung durch unsere IT-Experten.
Für SAP-Anwender:
Maximieren Sie Ihren Nutzen durch nahtlose Integration mit unserem UDI EUDAMED SAP Add-On.
Was unsere Kunden sagen
„Die Kombination aus Excel-Vorlage und Konvertierungsservice von Europe IT Consulting hat unseren EUDAMED-Einreichungsprozess revolutioniert. Was früher Tage dauerte, erledigen wir jetzt in Stunden – mit deutlich höherer Datenqualität.“ — Medizintechnik-Hersteller, Deutschland
„Die intuitive Struktur der Excel-Vorlage und die professionelle Unterstützung bei der XML-Konvertierung und EUDAMED-Übertragung geben uns die Sicherheit, stets konform zu bleiben.“ — Regulatory Affairs Manager, Schweiz
„Besonders wertvoll sind die vordefinierten Drop-Down-Menüs und die farbliche Markierung der Pflichtfelder. So haben wir immer den Überblick, welche Daten zwingend erforderlich sind.“ — Qualitätsmanager, Österreich
Häufige Fragen, die Ihre Entscheidung erleichtern
Fallen zusätzliche Kosten für Updates der Excel-Vorlage an?
Nein, alle wichtigen Updates der Vorlage sind ohne Aufpreis in Ihrem Erwerb enthalten.
Kann ich mit der Excel-Vorlage selbst XML-Dateien für EUDAMED erstellen?
Nein, die Excel-Vorlage dient ausschließlich der strukturierten Erfassung Ihrer UDI-Daten. Die Konvertierung in das komplexe EUDAMED-XML-Format bieten wir als separate Dienstleistung an, da dieser Prozess spezielle technische Expertise erfordert.
Wie erfolgt die Übertragung meiner Daten in die EUDAMED-Datenbank?
Nach der Datenerfassung in der Excel-Vorlage können Sie unseren Übertragungsservice in Anspruch nehmen. Unsere Experten konvertieren Ihre Daten ins richtige Format und übermitteln sie sicher an die EUDAMED-Datenbank.
Wie werden meine eingepflegten Daten gesichert?
Die Excel-Vorlage verfügt über integrierte Funktionen zur lokalen Datenspeicherung. Wir empfehlen zusätzlich regelmäßige Backups nach Ihren unternehmensinternen Sicherheitsrichtlinien.
Kann ich die Vorlage für mehrere Produkte oder Produktlinien verwenden?
Absolut. Die Vorlage ist so konzipiert, dass sie mehrere Basic UDI-DIs und zahlreiche zugehörige UDI-DIs in einer übersichtlichen Struktur verwalten kann.
Benötige ich spezielle Excel-Kenntnisse für die Nutzung der Vorlage?
Nein, die Vorlage wurde für Anwender mit grundlegenden Excel-Kenntnissen entwickelt. Die intuitive Bedienoberfläche und klare Strukturierung erleichtern die Eingabe auch ohne spezielle Vorkenntnisse.
Wird die Vorlage bei regulatorischen Änderungen aktualisiert?
Absolut! Wir aktualisieren proaktiv alle Wertelisten und integrieren neue Anforderungen, sobald die Europäische Kommission diese veröffentlicht – Ihre Garantie für dauerhafte Compliance.
Handeln Sie jetzt – sichern Sie sich Ihren regulatorischen Vorsprung!
Die Zeit drängt, und die EUDAMED-Fristen rücken näher. Entscheiden Sie sich heute für die Komplettlösung, der führende Medizintechnikunternehmen vertrauen.
Ihr erster Schritt zu optimierter UDI-Compliance:
Bitte füllen Sie das Formular aus für ein Angebot
Investieren Sie jetzt in eine effiziente regulatorische Strategie!
Die EUDAMED MDR/IVDR Excel-Vorlage wird entwickelt und vertrieben von der Europe IT Consulting GmbH, Ihrem zertifizierten Partner für regulatorische IT-Lösungen seit 2011.
