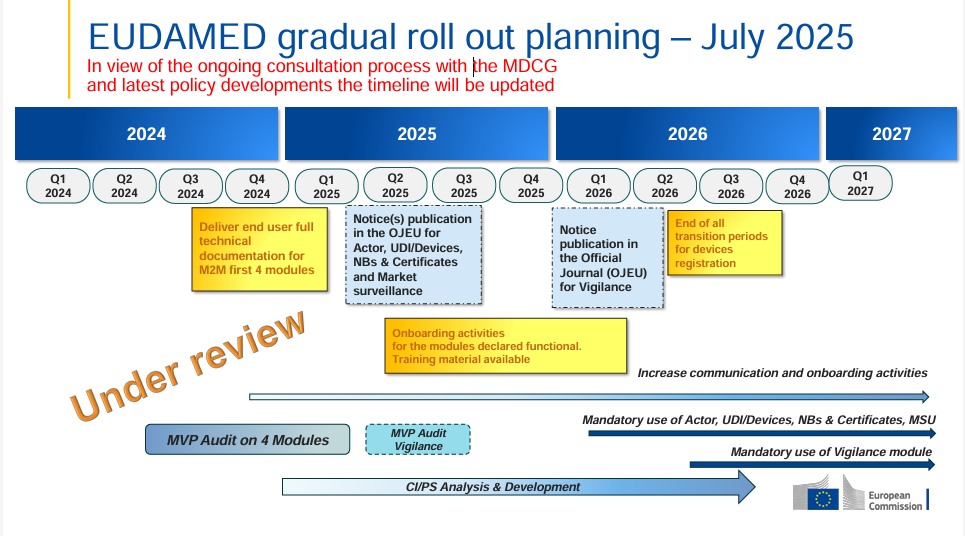
Die Europäische Kommission hat den EUDAMED-Rollout-Plan aktualisiert (Juli 2025) – und dieses Mal mit einem klaren Hinweis: Der Zeitplan steht „under review“. Das bedeutet, dass aktuell im Rahmen eines MDCG‑Konsultationsprozesses politische und regulatorische Entwicklungen berücksichtigt werden.
Was ist neu?
-
„Under review“ ist jetzt prominent im Zeitplan vermerkt – im Januar war das noch nicht der Fall.
-
Der Plan bleibt inhaltlich ähnlich (OJEU‑Bekanntmachungen für Actor, UDI/Devices, Notified Bodies & Certificates, Market Surveillance voraussichtlich Q2 2025; Vigilance‑Modul Q4 2025; Pflichtnutzung ab Q1 2026), aber die Überprüfung signalisiert: Änderungen sind möglich.
Warum das wichtig ist:
-
Herstellern und Vertretern empfiehlt sich aktives Monitoring der Entwicklungen, um bei eventuellen Verschiebungen sofort reagieren zu können.
-
Weiterhin wichtig: Die Onboarding-Phase im Jahr 2025 nutzen für Testläufe, Training und technische Vorbereitung.
-
Die Möglichkeit einer Anpassung der Fristen erfordert flexible Planung, aber auch frühzeitige Vorbereitung auf Pflicht-Use und Trainings.






Related Posts