
Was Kontaktlinsen-Hersteller jetzt über die Master UDI-DI wissen müssen
Die Medical Device Coordination Group (MDCG) hat Ende August 2025 die überarbeitete Leitlinie MDCG 2024-14 Rev.1 veröffentlicht. Sie behandelt die praktische Umsetzung der sogenannten Master UDI-DI speziell für Kontaktlinsen und liefert Herstellern eine klare Richtschnur für den regulatorisch sicheren Umgang mit dieser neuen Identifikationsform. Neben technischen Anpassungen und inhaltlicher Schärfung enthält die Revision vor allem eines: eine neue Frist für die verpflichtende Anwendung – und damit mehr Zeit für Hersteller, ihre Prozesse, IT und Labeling entsprechend umzustellen.
Was ist die Master UDI-DI und warum ist sie wichtig?
Die Master UDI-DI ist ein neu eingeführter Produktschlüssel, der es ermöglicht, sehr ähnliche Varianten eines Medizinprodukts unter einer gemeinsamen Identität zusammenzufassen – vorausgesetzt, sie teilen bestimmte klinisch relevante Designparameter. Für Kontaktlinsen, die typischerweise in Hunderten Varianten (z. B. verschiedene Dioptrien, Radien oder Durchmesser) erhältlich sind, reduziert die Master UDI-DI den administrativen und operativen Aufwand erheblich. Hersteller müssen nicht mehr jede Power-Variante mit einer eigenen UDI-DI registrieren, sondern können diese Varianten – sofern sie die definierte Gruppierungslogik erfüllen – unter einer Master UDI-DI bündeln.
Gleichzeitig dient die Master UDI-DI als zentrale Referenz für viele regulatorische Prozesse: Sie erscheint künftig auf dem Etikett der Produkte und wird bei Vigilance-Meldungen (z. B. bei Vorkommnissen oder Rückrufen) und der EUDAMED-Registrierung benötigt.
Neue Frist: Verpflichtende Anwendung ab dem 9. November 2026
Mit der Delegierten Verordnung (EU) 2025/788 wurde die ursprünglich für Mai 2025 vorgesehene Frist auf den 9. November 2026 verschoben. Diese Änderung gibt der Branche rund 18 Monate mehr Zeit, um sich auf die korrekte Einführung der Master UDI-DI vorzubereiten.
Doch die MDCG betont ausdrücklich: Auch wenn die Frist verlängert wurde, ist es strategisch klug, frühzeitig zu beginnen. Insbesondere im Zusammenhang mit Vigilance- und PMS-Prozessen ist es sinnvoll, bereits jetzt Master UDI-DIs zu vergeben und aktiv in die Systeme (z. B. ERP, PLM, LIMS) zu integrieren. Nur so lässt sich sicherstellen, dass betroffene Produkte im Falle eines Vorkommnisses eindeutig identifiziert und rückverfolgt werden können.
Welche Produkte können unter einer Master UDI-DI zusammengefasst werden?
Laut der neuen Leitlinie dürfen nur solche Kontaktlinsen unter einer Master UDI-DI gruppiert werden, die identische klinische Eigenschaften aufweisen. Als verbindliche Parameter nennt die MDCG:
-
BC (Base Curve) – die Basiskrümmung der Linse
-
DIA (Diameter) – der Gesamtdurchmesser der Linse
Darüber hinaus können weitere Parameter hinzukommen, wenn sie klinisch relevant sind. Dazu zählen beispielsweise:
-
Das Material der Linse (z. B. Hydrogel vs. Silikonhydrogel),
-
die Linsenart (sphärisch, torisch, multifokal),
-
vorhandene Filter oder Tönungen,
-
das Design der Rück- oder Vorderfläche.
Ein Hersteller darf also z. B. alle sphärischen Tageslinsen mit denselben BC- und DIA-Werten und identischem Material unter einer gemeinsamen Master UDI-DI führen – selbst wenn sie sich in der optischen Stärke (Dioptrien) unterscheiden. Dagegen müssen torische Linsen mit demselben BC und DIA, aber unterschiedlichem Material, getrennt behandelt werden, sofern das Material das klinische Verhalten beeinflusst.
Auswirkungen auf das Produkt-Labeling
Ein zentrales Element der neuen Regelung ist, dass die Master UDI-DI zukünftig die UDI-DI auf dem Produktlabel ersetzt. Für Kontaktlinsen bedeutet das konkret: Auf Einzelverpackungen (z. B. Blister) muss künftig nicht mehr jede Power-Variante eine eigene UDI-DI tragen. Stattdessen reicht die Master UDI-DI – ergänzt um die UDI-PI (z. B. LOT-Nummer, Seriennummer oder Herstellungsdatum), um das konkrete Exemplar rückverfolgbar zu machen.
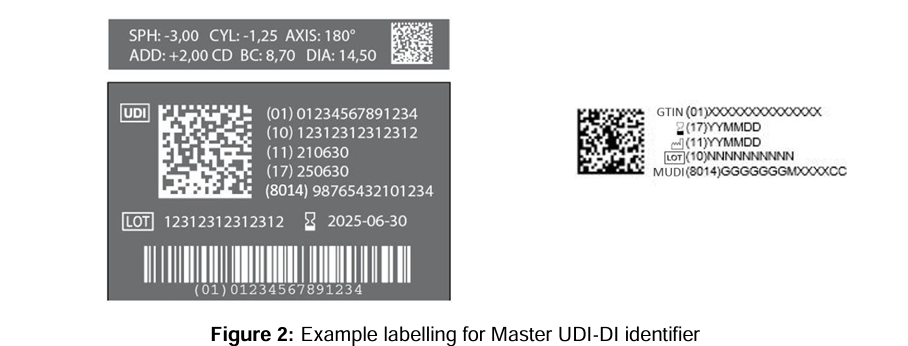
Quelle: MDCG 2024-14 Rev.1 – Guidance on the implementation of the Master UDI-DI solution for contact lenses
Komplexer wird es bei Mehrfachverpackungen (z. B. 6er-Boxen): Sind alle enthaltenen Linsen identisch in ihren klinischen Parametern, genügt eine gemeinsame Master UDI-DI. Variieren die Linsen jedoch in BC oder DIA, sind getrennte Verpackungslösungen oder separate Master UDI-DIs erforderlich.
Bedeutung für Vigilance und EUDAMED
Die MDCG stellt klar: Bei Vigilance-Meldungen, also etwa im Fall von Nebenwirkungen oder Rückrufen, muss künftig die vollständige UDI (Master UDI-DI + UDI-PI) gemeldet werden. Die Identifikation über die Basic UDI-DI oder über den Produktnamen reicht nicht mehr aus.
Im Übergangszeitraum – insbesondere vor dem verbindlichen Start der EUDAMED UDI/Device-Module – kann noch ein alternativer Rückverfolgbarkeitsweg über die EUDAMED-Device-ID und die UDI-PI gewählt werden. Dennoch ist der Aufbau einer funktionierenden Master-UDI-Infrastruktur bereits jetzt essenziell, um den kommenden regulatorischen Anforderungen gerecht zu werden.
Fazit: Jetzt ist der richtige Zeitpunkt, um zu starten
Auch wenn die verpflichtende Anwendung der Master UDI-DI für Kontaktlinsen auf den 9. November 2026 verschoben wurde, ist der Handlungsbedarf bereits jetzt da. Die überarbeitete Leitlinie liefert klare Kriterien, praxisnahe Beispiele und eine verlässliche Basis für die Umsetzung – sowohl technisch als auch prozessual. Hersteller sollten die verbleibende Zeit nutzen, um ihre Produktdaten zu strukturieren, Master UDI-DIs bei einer geeigneten Vergabestelle zu beantragen, Etiketten und Verpackungen anzupassen und ihre internen Vigilance- und EUDAMED-Prozesse auf die neuen Anforderungen vorzubereiten.
Über den Zeitplan haben wir bereits eine News veröffentlicht.
Wer frühzeitig handelt, hat nicht nur regulatorische Sicherheit, sondern kann auch interne Aufwände bei Datenpflege und Behördenkommunikation deutlich reduzieren.
Quellen:









Related Posts