UDI EUDAMED Genel Bakış
Avrupa Komisyonu’nun yeni Tıbbi Cihaz Yönetmeliği (MDR 2017/745) ve İn Vitro Diagnostik Cihaz Yönetmeliği (IVDR 2017/746) ile tıbbi cihazlar için yeni gereksinimler getirildi. Benzersiz Cihaz Tanımlama (UDI), tıbbi cihazların küresel olarak tanımlanmasını, izlenebilirliğini, şeffaflığını ve hasta güvenliğini artırmayı amaçlamaktadır.
Tıbbi Cihaz Üreticileri Üzerindeki UDI Etkisi
Avrupa pazarına tıbbi cihaz yerleştirmek için, tıbbi cihaz şirketlerinin bu yeni düzenlemelere uymaları, UDI’nin uygulanması da dahil olmak üzere gereklidir. Ürüne özgü UDI’lar Avrupa Tıbbi Cihaz Veritabanı (EUDAMED) için saklanmalı ve iletilmelidir. Her tıbbi cihazın Temel UDI-DI’ye atanması ve benzersiz bir UDI-DI’ye ihtiyacı vardır.
UDI Uygulama Zaman Çizelgesi
Yeni tıbbi düzenlemelerin tanıtılması, çoğu tıbbi cihaz şirketini ve ürün portföyünü büyük ölçüde etkiler. Bu nedenle, UDI uyumluluğu 2027’ye kadar aşamalı olarak kurulacak ve uygulanacaktır. Böylece, tıbbi cihazların risk sınıfına göre öncelik belirlenir.

UDI Proje Planı
MDR ve IVDR’nin yeni düzenlemelerinin gereksinimlerini karşılamak için, UDI uyumluluğuna giden yolculuğunuzda size yardımcı olacak adım adım bir yol haritası geliştirdik.

UDI Teknik Entegrasyon
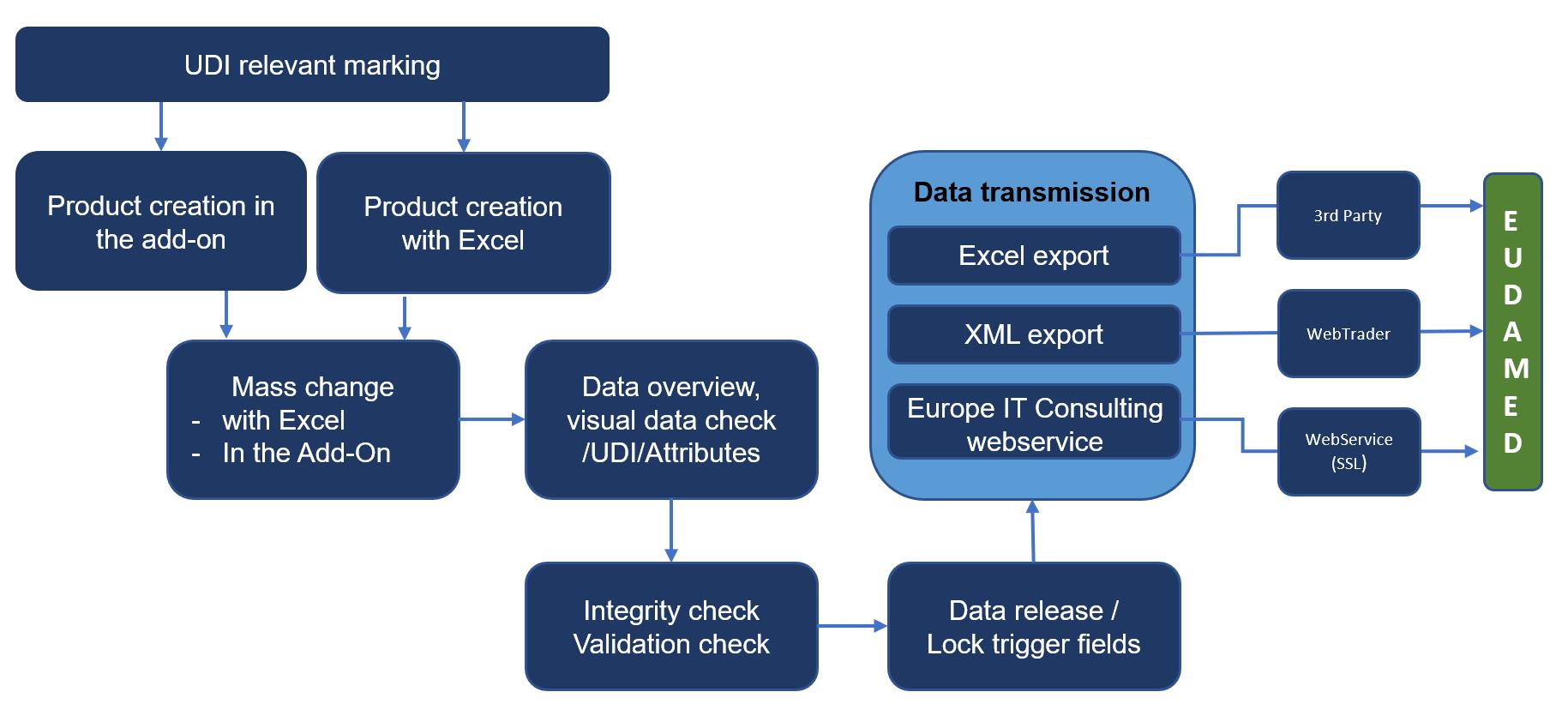
Etkili ve verimli bir UDI veri yönetimi için UDI EU SAP Eklentisi geliştirdik. Bu çözüm, UDI verilerinizi EUDAMED’e tek bir sistemde saklamanıza, yönetmenize ve iletişimlemenize yardımcı olur. Aşağıdaki resim, UDI EU SAP Eklentisi çözümündeki UDI veri yönetimi sürecini temsil eder.
UDI Veri Yönetimi
UDI İçin Çözümlerimiz:
UDI uygulaması hakkında daha fazla bilgi almak, teknik çözümlerimizi ve UDI hizmetlerimizi öğrenmek isterseniz, lütfen her zaman bizimle iletişime geçmekten çekinmeyin.