
Save the Date: regularia 2026 – Europe IT Consulting ist dabei
Am 3. März 2026 findet in der Stadthalle Tuttlingen erstmals die regularia statt – das neue Regulatorik-Forum für die Medizintechnik. Die Veranstaltung bringt Fach- und Führungskräfte aus Regulatory Affairs, Qualitätsmanagement, Politik und Industrie zusammen, um konkrete Lösungen für MDR, internationale Zulassungen, AI Act, Material Compliance und Nachhaltigkeit zu diskutieren. Europe IT Consulting wird als Aussteller vor Ort vertreten sein.
Was ist die regularia?
Die regularia wird von MedicalMountains in Tuttlingen organisiert und etabliert sich als zentrales Regulatorik-Forum für die Medizintechnik-Branche.
Das ganztägige Programm am 03.03.2026 in der Stadthalle Tuttlingen bietet:
- Begrüßung durch MedicalMountains
- Feierliche Eröffnung durch die Bundesgesundheitsministerin
- Mehrere parallele Fachsessions auf zwei Bühnen
- Abschließender Podiumstalk mit Vertreter:innen aus Politik und Wirtschaft
Zielgruppe:
- Geschäftsführer:innen
- Fach- und Führungskräfte aus Regulatory Affairs, Qualitätsmanagement und angrenzenden Bereichen
- Dienstleister, Labore und Benannte Stellen (begleitende Ausstellung)
Themen-Schwerpunkte der regularia 2026
Das veröffentlichte Programm gliedert sich in mehrere Themenblöcke auf zwei Bühnen („Blue Stage“ und „Green Stage“):
-
MDR & klinische Anforderungen
-
Erfahrungen mit der Umsetzung der MDR im Alltag
-
EUDAMED-Registrierung und der Umgang mit Unsicherheiten
-
PSURs zwischen regulatorischem Anspruch und praktischer Umsetzung
-
Klinische Bewertung und Sicherheit bei begrenzten klinischen Daten
-
-
Digitalisierung von RA und QM
-
Neugestaltung von RA-Prozessen mit digitalen Tools
-
Digitalisierung manueller Abläufe am Shopfloor
-
Digitale Dokumentation in RA, QM und Technik
-
KI-gestützte Identifikation und Analyse regulatorischer Änderungen
-
-
Internationale Zulassungen
-
Harmonisierung von US-Qualitätsanforderungen (z. B. QMSR)
-
Go-to-Market-Strategien für die USA in unsicheren Zeiten
-
Überblick zu UKCA, UKRP und MDR im Vereinigten Königreich
-
Einblicke in das Medizinprodukterecht z. B. in Saudi-Arabien
-
-
Material Compliance & Nachhaltigkeit / Green Deal
-
Nachhaltigkeit und Compliance als strategischer Wettbewerbsfaktor
-
PFAS-Beschränkungen und Auswirkungen auf Industrie und Versorgung
-
Änderungen relevanter Normen (u. a. Biokompatibilität, Mikroplastik)
-
EU-Green-Deal-Vorgaben und konkrete Auswirkungen auf MedTech-Unternehmen
-
Praxisberichte, wie MedTech-KMU Nachhaltigkeit umsetzen
-
Anforderungen der Batterieverordnung für medizintechnische Produkte
-
-
Cyber Security / Software / AI Act
-
Erfahrungen einer Benannten Stelle mit KI-basierten Medizinprodukten
-
Zusammenspiel von AI Act und MDR
-
Validierung und Zulassung von Systemen mit Sprachmodellen
-
Cybersecurity-Anforderungen über klassisches Risikomanagement hinaus
-
Produkthaftungsfragen im digitalen Umfeld
-
Damit deckt die regularia ein breites Spektrum ab – von klassischer MDR-Compliance über internationale Märkte bis hin zu KI, Cybersecurity und Nachhaltigkeit.
Warum die regularia für UDI- und Datenverantwortliche relevant ist
Für viele Hersteller ist die Zeit bis 2026 geprägt von:
-
EUDAMED-Implementierung und zunehmender Pflichtnutzung,
-
Swissdamed UDI Devices und nationalen Besonderheiten,
-
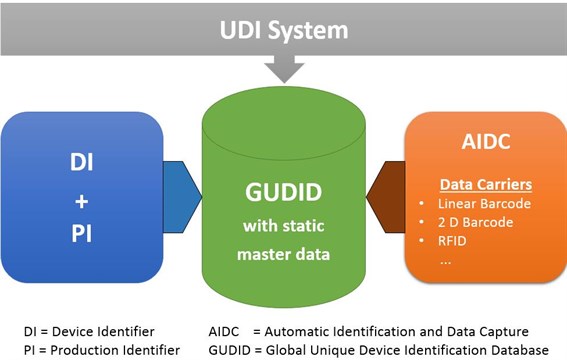
parallel laufenden Anforderungen aus FDA GUDID, UKCA & weiteren Märkten,
-
sowie wachsendem Druck, Datenqualität, Prozesse und Automatisierung zu verbessern.
Genau hier setzt Europe IT Consulting mit der Global UDI Data Management Solution (GUDI) und ergänzenden Services an – von Excel-Templates und Validierungstools bis zu SAP-integrierten UDI-Workflows.
Die regularia bietet den idealen Rahmen, um:
-
sich über aktuelle Regulierungsentwicklungen kompakt zu informieren,
-
Best Practices für UDI- und Digitalisierungsprojekte mitzunehmen und
-
konkrete Fragestellungen mit Expert:innen und Dienstleistern zu diskutieren.
Treffen Sie uns auf der regularia!
Für unsere Kunden und Partner ist die regularia eine ideale Gelegenheit für ein persönliches Treffen. Wir koordinieren gerne Termine rund um die Veranstaltung – direkt in Tuttlingen oder virtuell im Nachgang – um gemeinsam zu besprechen:
-
UDI-Roadmaps für EUDAMED, Swissdamed, FDA und weitere Behörden
-
Datenmodelle und Prozesse in SAP oder Nicht-SAP-Umgebungen
-
Konkrete Projekte im Bereich Global UDI, Datenvalidierung oder Schnittstellen
Offizielle Information und Anmeldung: regularia
Wir freuen uns auf den Austausch mit Ihnen in Tuttlingen!







Related Posts