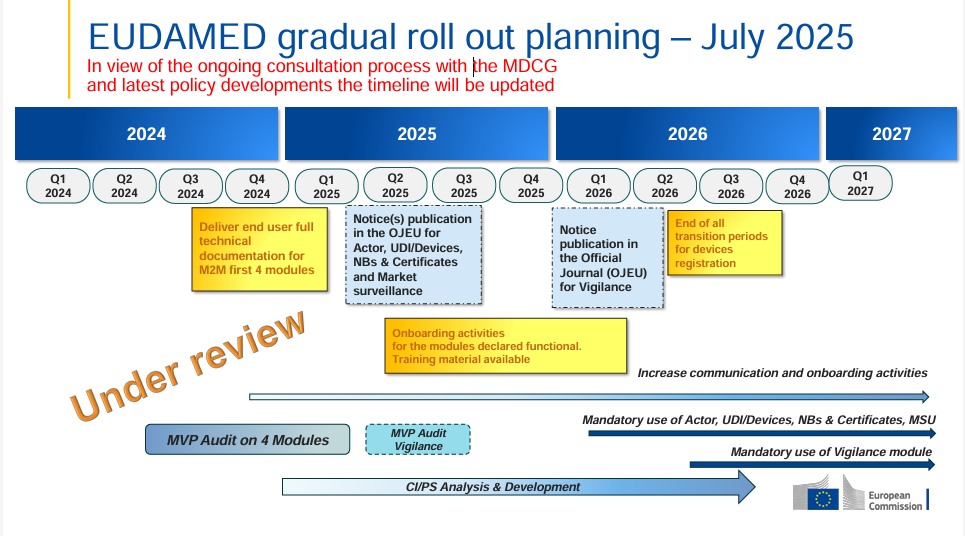
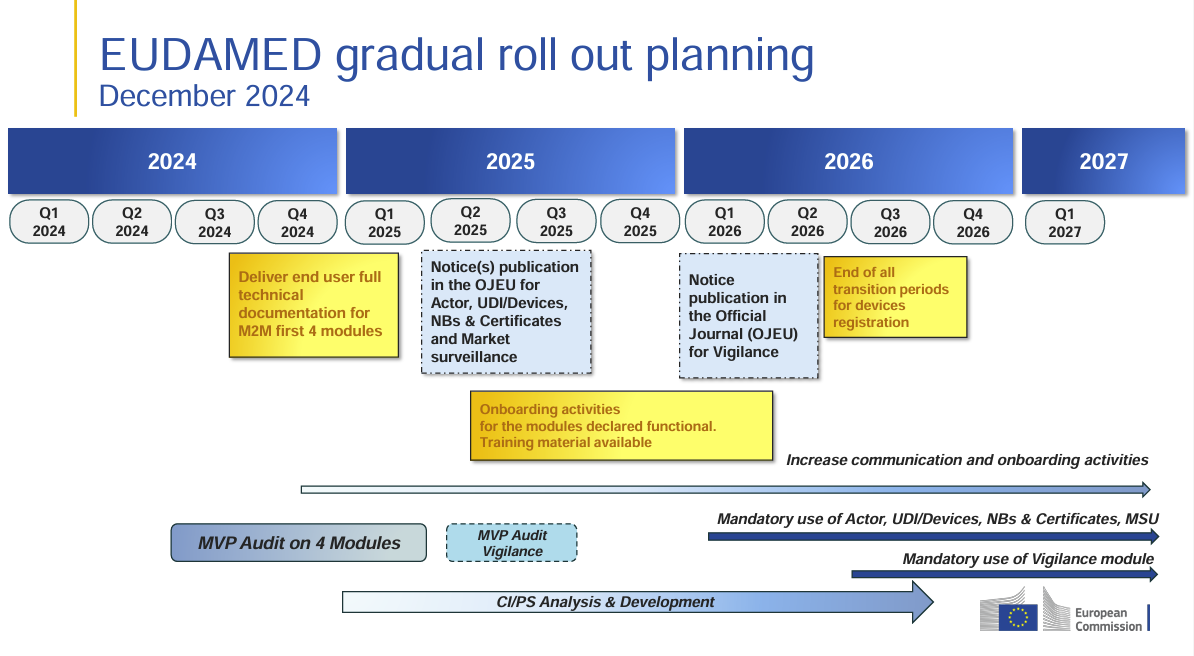
La Comisión Europea ha publicado un plan de implementación actualizado de EUDAMED (julio de 2025), esta vez con una nota clara: el cronograma está ahora “en revisión”. Esto indica que, en el marco del actual proceso de consulta del MDCG, se están teniendo en cuenta desarrollos políticos y regulatorios recientes.
¿Qué hay de nuevo?
-
La etiqueta “en revisión” aparece ahora de forma destacada en el cronograma; en la versión de enero de 2025 esto no estaba presente.
-
Los hitos principales siguen siendo los mismos (publicaciones en el DOUE para Actor, UDI/Devices, Organismos Notificados & Certificados, Vigilancia del Mercado previstas para el 2º trimestre de 2025; módulo de Vigilancia en el 4º trimestre de 2025; uso obligatorio a partir del 1º trimestre de 2026), pero la revisión señala que podrían producirse cambios.
Por qué es importante
-
Los fabricantes y las partes interesadas deben seguir de cerca las novedades para estar preparados ante posibles cambios en los plazos.
-
La fase de incorporación en 2025 sigue siendo fundamental para realizar pruebas, formación y preparación técnica.
-
La posibilidad de ajustes en las fechas exige una planificación flexible, pero también una preparación anticipada para el uso y la formación obligatorios.







Related Posts