
Lo que los fabricantes de lentes de contacto deben saber ahora sobre el Master UDI-DI
A finales de agosto de 2025, el Medical Device Coordination Group (MDCG) publicó la versión revisada de su directriz MDCG 2024-14 Rev.1. Este documento aborda la aplicación práctica del llamado Master UDI-DI, específicamente para lentes de contacto, y ofrece a los fabricantes una orientación clara para garantizar el cumplimiento normativo al implementar esta nueva forma de identificación. Además de ajustes técnicos y aclaraciones de contenido, la revisión incluye un cambio fundamental: una nueva fecha límite para su aplicación obligatoria, lo que brinda a los fabricantes más tiempo para adaptar sus procesos, sistemas informáticos y etiquetado.
¿Qué es el Master UDI-DI y por qué es importante?
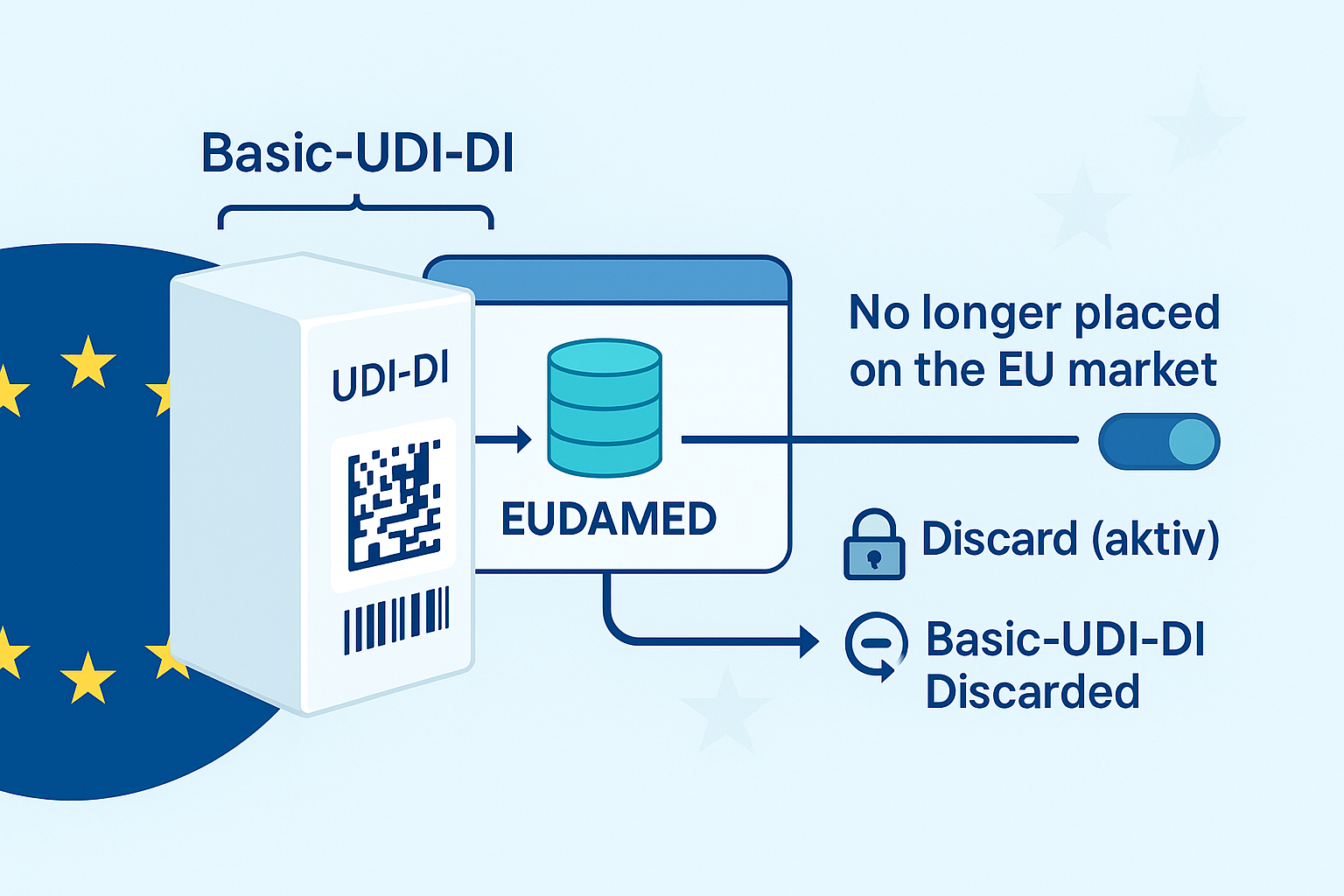
El Master UDI-DI es una nueva clave de producto que permite agrupar variantes muy similares de un producto sanitario bajo una identidad común, siempre que compartan ciertos parámetros de diseño clínicamente relevantes. En el caso de las lentes de contacto, que suelen estar disponibles en cientos de variantes (por ejemplo, distintas potencias, radios o diámetros), el Master UDI-DI reduce significativamente la carga administrativa y operativa. Los fabricantes ya no tendrán que asignar una UDI-DI única a cada variante de potencia, sino que podrán agruparlas bajo un único Master UDI-DI, siempre que cumplan con la lógica de agrupación definida en la guía.
Al mismo tiempo, el Master UDI-DI se convierte en un referente central para muchos procesos regulatorios. Aparecerá en el etiquetado del producto y será obligatorio para los informes de vigilancia (por ejemplo, incidentes o retiradas del mercado) y para el registro en EUDAMED.
Nueva fecha límite: aplicación obligatoria a partir del 9 de noviembre de 2026
El Reglamento Delegado (UE) 2025/788 ha pospuesto la fecha límite original (prevista para mayo de 2025) al 9 de noviembre de 2026. Este cambio otorga a la industria aproximadamente 18 meses adicionales para implementar correctamente el marco del Master UDI-DI.
Sin embargo, el MDCG recalca de forma explícita que, aunque se haya ampliado el plazo, es estratégicamente recomendable comenzar lo antes posible. En particular, en el contexto de la vigilancia y los procesos de PMS, es aconsejable comenzar ya a asignar los Master UDI-DI e integrarlos activamente en sistemas como ERP, PLM o LIMS. Solo así se podrá garantizar que los productos afectados puedan identificarse y rastrearse correctamente en caso de un incidente.
¿Qué productos pueden agruparse bajo un Master UDI-DI?
Según la nueva directriz, solo se pueden agrupar bajo un mismo Master UDI-DI aquellas lentes de contacto que presenten características clínicas idénticas. El MDCG define los siguientes parámetros obligatorios:
-
BC (curva base) – la curvatura base de la lente
-
DIA (diámetro) – el diámetro total de la lente
Además, pueden considerarse otros parámetros si son clínicamente relevantes, como:
-
Material de la lente (p. ej. hidrogel vs. hidrogel de silicona)
-
Tipo de lente (esférica, tórica, multifocal)
-
Filtros o tintes
-
Diseño de la superficie anterior o posterior
Por ejemplo, un fabricante puede agrupar todas las lentes diarias esféricas con el mismo BC, DIA y material bajo un único Master UDI-DI, incluso si difieren en potencia dióptrica. En cambio, las lentes tóricas con el mismo BC y DIA pero material diferente deben agruparse por separado si ese material afecta el comportamiento clínico del producto.
Impacto en el etiquetado del producto
Uno de los cambios clave de la nueva directriz es que el Master UDI-DI sustituirá a la UDI-DI en el etiquetado del producto para lentes de contacto. En concreto, esto significa que ya no será necesario asignar una UDI-DI individual a cada variante de potencia en envases unitarios (por ejemplo, blísters). En su lugar, bastará con el Master UDI-DI, acompañado de la UDI-PI (por ejemplo, número de lote, número de serie o fecha de fabricación), para garantizar la trazabilidad del producto individual.
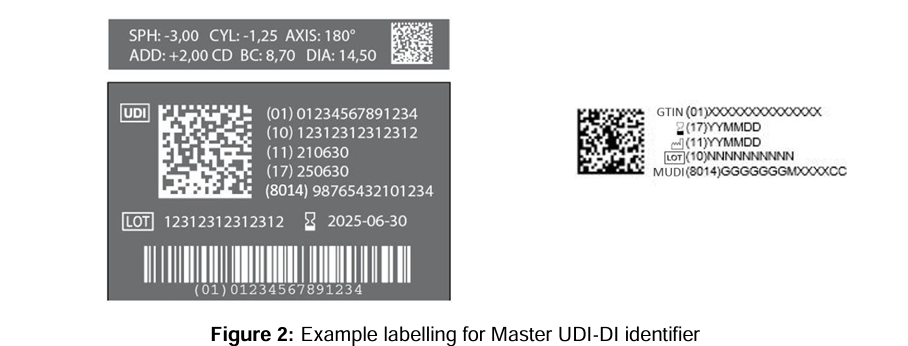
Quelle: MDCG 2024-14 Rev.1 – Guidance on the implementation of the Master UDI-DI solution for contact lenses
La situación se complica en el caso de envases múltiples (por ejemplo, cajas de 6 unidades): si todas las lentes del paquete tienen los mismos parámetros clínicos, se puede usar un único Master UDI-DI. Pero si difieren en BC o DIA, se requerirán soluciones de empaquetado separadas o múltiples Master UDI-DIs.
Importancia para la vigilancia y EUDAMED
El MDCG aclara que, para los informes de vigilancia, como los relacionados con efectos adversos o retiradas de producto, será obligatorio notificar la UDI completa (Master UDI-DI + UDI-PI). Ya no será suficiente identificar el producto con la Basic UDI-DI o su nombre comercial.
Durante el periodo de transición – especialmente antes de que los módulos de UDI/Dispositivos de EUDAMED sean obligatorios – todavía se podrá usar un camino alternativo de trazabilidad, mediante el ID del dispositivo en EUDAMED y la UDI-PI. No obstante, establecer una infraestructura sólida para los Master UDI-DI es esencial desde ahora para cumplir con los próximos requisitos regulatorios.
Conclusión: ahora es el momento adecuado para actuar
Aunque la aplicación obligatoria del Master UDI-DI para lentes de contacto se ha pospuesto hasta el 9 de noviembre de 2026, ya existe una clara necesidad de actuar. La directriz revisada proporciona criterios claros, ejemplos prácticos y una base sólida para la implementación, tanto desde el punto de vista técnico como procedimental.
Los fabricantes deben aprovechar el tiempo adicional para:
-
estructurar sus datos de producto,
-
solicitar Master UDI-DIs a una entidad emisora autorizada,
-
adaptar el etiquetado y los envases,
-
y preparar sus procesos internos de vigilancia y registro EUDAMED.
Ya hemos publicado una noticia separada sobre el nuevo calendario.
Quienes actúen con antelación no solo garantizarán el cumplimiento normativo, sino que también podrán reducir significativamente el esfuerzo interno relacionado con la gestión de datos y la comunicación con las autoridades.
Quellen:







Related Posts